
【题目】根据题意解答
(1)在实验室里做钠跟水反应的实验时,可能用到的仪器是 . (填序号,多选不得分,少选扣分)
a.试管夹 b.镊子 c.小刀 d.冷凝管 e.滤纸 f.研钵
g.烧杯 h.坩埚 i.石棉网 j.玻璃片 k.药匙 l.燃烧匙
(2)某课外活动小组研究金属钾的性质.他们通过Na、K原子结构示意图及查找有关资料,知道了Na、K属于同一类物质,且K燃烧生成产物是KO2 . 请完成下列内容:
①观察钾的切面.硬度: , 颜色:
②预测钾的性质,并进行实验验证(用化学方程式表示):
在空气中缓慢氧化:;
点燃,发生剧烈燃烧: .
③结论:钾是一种活泼的金属单质,其化学性质比钠活泼.
④该小组研究钾的性质用到了哪几种方法? .
(3)用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2 , 装置如图所示. 
请回答下列问题:
①B中选用的试剂是饱和食盐水,其作用是;
②D中反应的化学方程式是;
③E中发生的反应的离子方程式是 .
【答案】
(1)bcegj
(2)小;银白;4K+O2=2K2O;K+O2 ![]() KO2;观察、实验、分类、比较
KO2;观察、实验、分类、比较
(3)除去氯气中混有的氯化氢气体;Cu+Cl2 ![]() CuCl2;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
CuCl2;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
【解析】解:(1)实验室里做钠跟水反应的实验时,取用块状固体药品时用镊子,将金属钠放在玻璃片上,用小刀切一小块钠,用滤纸擦干表面的煤油,用烧杯盛放水,用玻璃棒覆盖烧杯,防止钠飞出,所以用到的仪器是镊子、小刀、滤纸、烧杯、玻璃片,则是bcegj;所以答案是:bcegj;(2)①碱金属硬度减小,一般为银白色,所以钾的硬度小,颜色为银白色,
所以答案是:小; 银白;②①金属钾在空气中缓慢氧化生成的是氧化剂,反应的化学方程式为:4K+O2═2K2O,
所以答案是:4K+O2═2K2O; ②由题意可知,钾在空气中燃烧的产物是超氧化钾(KO2),反应的化学方程式为K+O2 ![]() KO2 ,
KO2 ,
所以答案是:K+O2 ![]() KO2;④首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处.然后预测性质并通过实验验证,通过实验现象,通过观分解释、整合,进而得出结论,所以该小组研究钾的性质用到了观察、实验、分类、比较的方法,
KO2;④首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处.然后预测性质并通过实验验证,通过实验现象,通过观分解释、整合,进而得出结论,所以该小组研究钾的性质用到了观察、实验、分类、比较的方法,
所以答案是:观察、实验、分类、比较;(3)①氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以可以用盛有饱和食盐水的B除去氯气中混有的氯化氢;
所以答案是:除去氯气中混有的氯化氢气体;②铜粉在氯气中燃烧生成氯化铜,化学方程式:Cu+Cl2 ![]() CuCl2;
CuCl2;
所以答案是:Cu+Cl2 ![]() CuCl2;③氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
CuCl2;③氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.
【考点精析】本题主要考查了氯气的实验室制法和碱金属的性质的相关知识点,需要掌握实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;原子半径为同周期最大,易失电子.强还原剂且从Li→Cs金属性增强;取高价氧化物的水化物呈强碱性,从Li→Cs碱性增强才能正确解答此题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是( )

A. 图中温度T1>T2
B. 曲线a、b均代表纯水的电离情况
C. 图中五点Kw间的关系:B>C>A=D=E
D. 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等做沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用的沉淀剂最好为( )
A. 碳酸盐 B. 硫酸盐 C. 硫化物 D. 以上沉淀剂均可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的质量分数为( )
A. 25% B. 75% C. 88% D. 32%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图变化的是( )
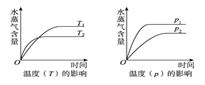
A. CH3CH2OH(g) ![]() CH2=CH2(g)+H2O(g) ΔH>0
CH2=CH2(g)+H2O(g) ΔH>0
B. CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
C. CO2(g)+2NH3(g) ![]() CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
D. 2C6H5CH2CH3(g)+O2(g) ![]() 2C6H5CHCH2(g)+2H2O(g)ΔH<0
2C6H5CHCH2(g)+2H2O(g)ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
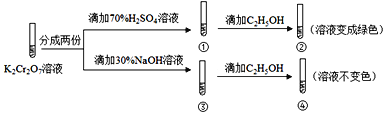
A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+ ![]() O2(g)
O2(g) ![]() SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )
A. 196.64kJ B. 196.64kJ/mol
C. <196.64kJ D. >196.64kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com