
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源:2016-2017学年湖南省衡阳市高二理科实验班下学期第一次月考理综化学试卷(解析版) 题型:选择题
已知常温下在溶液中可发生如下两个离子反应Ce4++Fe2+=Fe3++ Ce3+ ,Sn2+ + 2Fe3+ = 2Fe2+ + Sn4+。由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性最强和最弱的离子分别是
A. Sn2+和Ce3+ B. Sn2+和Fe2+
C. Ce3+和Sn2+ D. Fe2+和Ce3+
查看答案和解析>>
科目:高中化学 来源:浙江省衢州市2017届高三1月教学质量检测化学试卷 题型:选择题
下列物质的水溶液因水解呈碱性的是
A. HCl B. NaOH C. CH3COONa D. Na2SO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二学业水平模拟测试化学试卷(解析版) 题型:选择题
操作规范是化学实验的基本要求。下列实验操作正确的是
A. 检查容量瓶是否漏水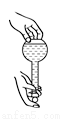 B. 给液体加热
B. 给液体加热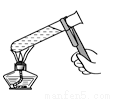
C. 滴加试液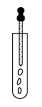 D. 过滤
D. 过滤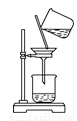
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二学业水平模拟测试化学试卷(解析版) 题型:选择题
下列物质中含有离子键的是
A. Cl2 B. CO2 C. NaOH D. HCl
查看答案和解析>>
科目:高中化学 来源:2017届山东省青岛市高三第一次统一质量检测理综化学试卷(解析版) 题型:简答题
氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
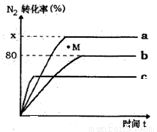
①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s) Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+ [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省青岛市高三第一次统一质量检测理综化学试卷(解析版) 题型:选择题
下列有关乙二酸(HOOC-COOH)的说法中正确的是(设NA为阿伏加德罗常数的值)
A. 标准状况下90g乙二酸所占的体积约为22.4L
B. lmol乙二酸中含有共用电子对的数目为9NA
C. 90g乙二酸被NaC1O氧化生成CO2,转移的电子数为NA
D. 0.lmol·L-1的乙二酸溶液中,H2C2O4、C2O42-和HC2O4-的微粒数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市宝应县高二下学期学业水平测试(三)化学试卷(解析版) 题型:选择题
三草酸合铁(III)酸钾Kx[Fey(C2O4)z]•nH2O可用于摄影。为确定其组成进行如下实验:
步骤1:准确称取该晶体0.9820g,配成溶液,平均分成10份。
步骤2:取一份溶液,酸化,加热,用SnCl2-TiCl3将Fe3+全部还原为Fe2+,再加0.0100mol•L-1KMnO4至恰好反应,将C2O42-全部氧化成CO2,Fe2+全部氧化成Fe3+,消耗KMnO4体积28.00mL。
步骤3:另取一份溶液,酸化,加入0.0100mol•L-1KMnO4至恰好反应完全,将C2O42-全部氧化成CO2,消耗KMnO4体积24.00mL。(已知:MnO4-还原产物为Mn2+,上述实验数据为多次实验有效数据平均值)
下列判断正确的是
A. 取溶解后待测液少许,先加少量氯水,再加KSCN产生血红色溶液,则有Fe2+
B. 步骤3的离子方程式为:5C2O42-+2MnO4-+8H2O =10CO2 ↑+2Mn2++16OH-
C. x:z = 1:2
D. 该晶体的化学式为:K3[Fe(C2O4)3]•3H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
反应SO2(g)+NO2(g) NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是( )
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是( )
A. 平衡左移,容器内压强一定增大
B. 平衡右移,达到平衡时容器压强一定增大
C. 平衡不一定发生移动,容器内压强一定增大
D. 平衡右移,SO2的转化率提高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com