
【题目】一氯胺(NH2Cl,Cl呈+1价)可用于制备液体火箭燃料偏二甲肼。
实验一:制备NH2Cl实验室制备一氯胺可用氨气与次氯酸钠反应,反应方程式为NH3+NaClO=NH2Cl+NaOH。某实验小组设计如下装置制备NH2Cl。
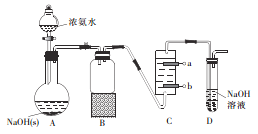
(1)B装置的作用为_________________
(2)C中盛装的是饱和食盐水,则惰性电极b应与电源_______极相连。
(3)先电解一段时间后,接下来的实验操作是______。
实验二:检测自来水中的一氯胺的含量.一氯胺是重要的水消毒剂,利用碘量法可以检测自来水中一氯胺的含量.其主要方法为:取已加入一氯胺的自来水20.00mL.加入过量的碘化钾溶液,充分反应后,用0.100 mol/L的Na2S2O3溶液进行滴定,达到终点时,消耗Na2S2O3溶液5.00 mL。
已知:NH2Cl+3I-+2H2O=NH3H2O+OH-+Cl-+I3- I3-![]() I2+I- I2+2S2O32-=2I-+S4O62-
I2+I- I2+2S2O32-=2I-+S4O62-
(4)滴定时用___作指示剂,判定达到滴定终点的现象是___________。
(5)该自来水中一氯胺的浓度为____________mol/L。
【答案】安全瓶 正 先打开止水夹,再打开分液漏斗的活塞 淀粉 溶液由蓝色变为无色,且半分钟颜色不再变化 0.0125
【解析】
(1)根据氨气极易溶于水,容易倒吸;
(2)b极应产生氯气与a极产生的氢氧化钠充分接触生成次氯酸钠,阴离子在阳极放电,与电源的正极相连;
(3)电解一段时间后,应制备氨气并通入到C中与次氯酸钠反应;
(4)碘遇淀粉变蓝色,故选择淀粉作指示剂,当溶液由蓝色变为无色,且半分钟颜色不再变化说明滴定到达终点;
(5)由方程式:NH2Cl+3I-+2H2O=NH3H2O+OH-+Cl-+I3-、I3-![]() I2+I-、I2+2S2O32-═2I-+S4O62-可得到关系式:NH2Cl~I3-~I2~2S2O32-进行计算。
I2+I-、I2+2S2O32-═2I-+S4O62-可得到关系式:NH2Cl~I3-~I2~2S2O32-进行计算。
(1)根据氨气极易溶于水,容易倒吸,所以B装置的作用为安全瓶;
(2)b极应产生氯气与a极产生的氢氧化钠充分接触生成次氯酸钠,氯离子在阳极放电,所以b是阳极,与电源的正极相连;
(3)先电解一段时间后,接下来的实验操作通入制备氨气并通入到C中,即先打开止水夹,再打开分液漏斗的活塞;
(4)碘遇淀粉变蓝色,故选择淀粉作指示剂,判定达到滴定终点的现象是当溶液由蓝色变为无色,且半分钟颜色不再变化;
(5)由方程式:NH2Cl+3I-+2H2O=NH3H2O+OH-+Cl-+I3-、I3-![]() I2+I-、I2+2S2O32-=2I-+S4O62-;
I2+I-、I2+2S2O32-=2I-+S4O62-;
可得到关系式:NH2Cl~I3-~I2 ~2S2O32-;
n(Na2S2O3)=2n(NH2Cl),2×c(NH2Cl)×20×10-3L=0.100 mol/L×5×10-3L,
解得:c(NH2Cl)=0.0125mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中进行反应CH4(g) + H2O(g) ![]() CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是

A. p1>p2
B. ΔH<0
C. 加入催化剂可以提高甲烷的转化率
D. 恒温下,缩小容器体积,平衡后CH4浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应④2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为
A.488.3 kJ/molB.-224.15 kJ/mol
C.-488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是
A. x=2.4
B. T1、T2的关系:T1>T2
C. K1、K2的关系:K2>K1
D. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是
A. 2.0gH218O与D216O的混合物中所含中子数为NA
B. 0.1molCl2溶于足量水中,转移的电子数为0.1NA
C. 常温常压下50g46%的乙醇溶液中,所含氧原子数目为0.5NA
D. 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeSO4![]() Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是
Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是
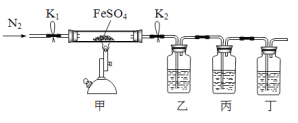
A. 乙、丙、丁中依次盛装的试剂可以是BaCl2溶液、品红溶液、NaOH溶液
B. 实验开始时,先打开K1和K2,缓缓通入N2一段时间,再点燃酒精喷灯加热
C. 若丙中盛装的是酸性KMnO4溶液检验SO2气体时,则SO2表现出还原性
D. 为了检验甲中残留固体中含有Fe3+,取少量固体加入稀硝酸溶解,再滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由烃A制备抗结肠炎药物H的一种合成路线如下 (部分反应略去试剂和条件):

回答下列问题:
(1)H的分子式是_____,A的化学名称是______。反应②的类型是_______。
(2)D的结构简式是___________。F中含有的官能团的名称是____________。
(3)E与足量NaOH溶液反应的化学方程式是______________。
(4)设计C→D和E→F两步反应的共同目的是_________。
(5)化合物X是H的同分异构体,X遇FeCl3溶液不发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为3∶2∶2,写出1种符合要求的X的结构简式_________________。
(6)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物![]() 的合成路线_______________________________(其他试剂任选)。
的合成路线_______________________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:3A(g)+B(g)=2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为:
①v(A)=0.6 mol· L-1·min-1 ②v(B)=0.45 mol· L-1·min-1
③v(C)=0.015 mol· L-1·min-1 ④v(D)=0.45 mol· L-1·min-1
则此反应在不同条件下进行最快的是
A.③B.①C.②D.④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com