
ĢśŹĒŅ»ÖÖ¹ż¶ÉŌŖĖŲ£¬½šŹōĢśŹĒ×ī³£ÓĆµÄ½šŹō”£Ēė»Ų“šĻĀĮŠø÷Ģā£ŗ
£Ø1£©ÉśĢśÖŠŗ¬ÓŠŅ»ÖÖĢśĢ¼»ÆŗĻĪļ(Fe3C)£¬ŌŚ×ćĮæµÄæÕĘųÖŠøßĪĀģŃÉÕ£¬Éś³ÉÓŠ“ÅŠŌµÄ¹ĢĢåŗĶÄÜŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×ĒµÄĘųĢ壬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£ÉĻŹö·“Ӧɜ³ÉµÄ“ÅŠŌ¹ĢĢåÄÜČÜÓŚ¹żĮæŃĪĖį£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø2£©ŌŚFe2+»ņFe3+µÄ“ß»Æ×÷ÓĆĻĀ£¬æÉŹµĻÖ2SO2+O2+2H2O=2H2SO4µÄ×Ŗ»Æ”£ŅŃÖŖŗ¬SO2µÄ·ĻĘųĶØČėŗ¬Fe2+µÄČÜŅŗŹ±£¬ĘäÖŠŅ»øö·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+£¬ŌņĮķŅ»·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø3£©ĮņĖį³§ÓĆģŃÉÕ»ĘĢśæó(FeS2)Ą“ÖĘČ”ĮņĖį£¬ŹµŃéŹŅĄūÓĆĮņĖį³§ÉÕŌü(Ö÷ŅŖ³É·ÖŹĒFe2O3¼°ÉŁĮæFeS”¢SiO2)ÖĘĀĢ·Æ”£ĄūÓĆÉÕŌüÖĘĀĢ·ÆµÄ¹ż³ĢČēĻĀ£ŗ
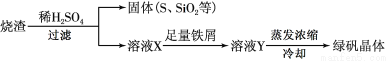
¢ŁÉÕŌüČÜÓŚĻ”H2SO4¹ż³ĢÖŠ£¬ĻČŹĒ¹ĢĢå“ó²æ·Ö±»Čܽā£¬½Ó×ÅÓŠµ„ÖŹĮņÉś³É£¬Š“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½(Ö»Š“Éś³ÉSµÄĄė×Ó·½³ĢŹ½£¬ĘäĖū·“Ó¦ĪŽŠčŠ“³ö) ”£
¢ŚĻņČÜŅŗXÖŠ¼ÓČė×ćĮæĢśŠ¼µÄÄæµÄŹĒ ”£
¢ŪČ”1.6gĖłµĆ¾§ĢåѳʷÅä³ÉČÜŅŗ£¬µĪČė mL 0.1000 mol/L µÄĖįŠŌøßĆĢĖį¼ŲŅŗøÕŗĆĶźČ«·“Ó¦£¬¾¼ĘĖćæɵĆѳʷ֊ŗ¬47.5%µÄĮņĖįŃĒĢś”£
£Ø4£©ŅŃÖŖFe(OH)3µÄČܶȻż³£ŹżKsp£½1.1”Į10-36”£ŹŅĪĀŹ±ŌŚFeCl3ČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗ£¬µ±ČÜŅŗpH=3Ź±£¬Ķعż¼ĘĖćĖµĆ÷Fe3+ŹĒ·ń³ĮµķĶźČ« ”£
(ĢįŹ¾£ŗµ±Ä³Ąė×ÓÅØ¶ČŠ”ÓŚ1.0”Į10-5 mol•L-1Ź±æÉŅŌČĻĪŖøĆĄė×Ó³ĮµķĶźČ«ĮĖ)
 Ö±ĶعóÖŻĆūŠ£ÖܲāŌĀæ¼Ö±ĶØĆūŠ£ĻµĮŠ“š°ø
Ö±ĶعóÖŻĆūŠ£ÖܲāŌĀæ¼Ö±ĶØĆūŠ£ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016Ń§ÄźÉ½¶«Ź”ĮŁŅŹŹŠøßŅ»ĻĀŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÓŠ¹Ų·ÅČČ·“Ó¦”¢ĪüČČ·“Ó¦µÄĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A£®ĪüČČ·“Ó¦µÄ·¢Éś¶¼ŠčŅŖ¼ÓČČ£¬·ÅČČ·“Ó¦ŌŚ³£ĪĀĻĀŅ»¶ØČŻŅ×·¢Éś
B£®Čōij·“Ó¦ÕżĻņ½ųŠŠŹ±ĪŖ·ÅČČ·“Ó¦£¬ŌņøĆ·“Ó¦ÄęĻņ½ųŠŠŹ±±ŲĪŖĪüČČ·“Ó¦
C£®ÓÉ”°C£ØŹÆÄ«£©= C£Ø½šøÕŹÆ£©ŹĒĪüČČ·“Ó¦ ”±æÉÖŖŹÆÄ«±Č½šøÕŹÆĪȶØ
D£®²»¹ÜŹĒĪüČČ·“Ó¦»¹ŹĒ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶Č£¬·“Ó¦ĖŁĀŹ¾łŌö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģÄžĻÄŅų“ØŅ»ÖŠøßČżČżÄ£Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
Ļ”ĶĮŌŖĖŲŹĒÖøŌŖĖŲÖÜĘŚ±ķÖŠŌ×ÓŠņŹżĪŖ57µ½71µÄ15ÖÖļēĻµŌŖĖŲ£¬ŅŌ¼°ÓėļēĻµŌŖĖŲ»ÆѧŠŌÖŹĻąĖʵÄīÖ(Sc)ŗĶīĘ(Y)¹²17ÖÖŌŖĖŲ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©īÖ(Sc)ŌŖĖŲµÄŌ×ÓŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ______________________”£ļį(Dy)µÄ»łĢ¬Ō×Óµē×ÓÅŲ¼Ź½ĪŖ[Xe]4f106s2£¬Ņ»øö»łĢ¬ļįŌ×ÓĖłŗ¬µÄĪ“³É¶Ōµē×ÓŹżĪŖ________”£
£Ø2£©Ļ”ĶĮŌŖĖŲ×ī³£¼ūµÄ»ÆŗĻ¼ŪĪŖ+3¼Ū£¬µ«Ņ²ÓŠÉŁŹż»¹ÓŠ+4¼Ū”£Ēėøł¾ŻĻĀ±ķÖŠµÄµēĄėÄÜŹż¾ŻÅŠ¶Ļ±ķÖŠ×īÓŠæÉÄÜÓŠ+4¼ŪµÄŌŖĖŲŹĒ________”£¼øÖÖĻ”ĶĮŌŖĖŲµÄµēĄėÄÜ(µ„Ī»£ŗkJ”¤mol-1)
ŌŖĖŲ | I1 | I2 | I3 | I4 |
Sc(īÖ) | 633 | 1 235 | 2 389 | 7 019 |
Y(īĘ) | 616 | 1 181 | 1 980 | 5 963 |
La(ļē) | 538 | 1 067 | 1 850 | 4 819 |
Ce(īę) | 527 | 1 047 | 1 949 | 3 547 |
£Ø3£©Ąė×Ó»ÆŗĻĪļNa3[Sc(OH)6]ÖŠ£¬“ęŌŚµÄ×÷ÓĆĮ¦³żĄė×Ó¼üĶā»¹ÓŠ____________”£
£Ø4£©Sm(īĢ)µÄµ„ÖŹÓė1£¬2-¶žµāŅŅĶéæÉ·¢ÉśČēĻĀ·“Ó¦£ŗ
Sm+ICH2CH2I SmI2+CH2£½CH2”£ICH2CH2IÖŠĢ¼Ō×ÓŌÓ»ÆĄąŠĶĪŖ______________£¬1 mol CH2£½CH2ÖŠŗ¬ÓŠµÄ¦Ņ¼üŹżÄæĪŖ________”£
SmI2+CH2£½CH2”£ICH2CH2IÖŠĢ¼Ō×ÓŌÓ»ÆĄąŠĶĪŖ______________£¬1 mol CH2£½CH2ÖŠŗ¬ÓŠµÄ¦Ņ¼üŹżÄæĪŖ________”£
£Ø5£©PrO2(¶žŃõ»Æļč)µÄ¾§Ģå½į¹¹ÓėCaF2ĻąĖĘ£¬¾§°ūÖŠļčŌ×ÓĪ»ÓŚĆęŠÄŗĶ¶„µć”£ŌņPrO2(¶žŃõ»Æļč)µÄ¾§°ūÖŠÓŠ________øöŃõŌ×Ó”£
£Ø6£©Ce(īę)µ„ÖŹĪŖĆęŠÄĮ¢·½¾§Ģ壬¾§°ū²ĪŹżĪŖa=516 pm£¬¾§°ūÖŠCe(īę)µÄÅäĪ»ŹżĪŖ________£¬ĮŠŹ½±ķŹ¾Ce(īę)µ„ÖŹµÄĆÜ¶Č£ŗ_______g”¤cm-3(²»±Ų¼ĘĖć³ö½į¹ū)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģĮÉÄžŹ”øßČż°ĖÄ£Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
֊ѧ³£²ÉÓĆøßĆĢĖį¼Ų¼ÓČČ·Ö½ā·ØÖĘČ”ŃõĘų£¬Ä³ŠĖȤŠ”×é¾²éŌÄ׏ĮĻ»ńÖŖ£ŗÖʵĆŃõĘųŗó¹ĢĢå²ŠÓąĪļÖŠµÄĆĢĖį¼Ų(K2MnO4)¾ßÓŠĒæŃõ»ÆŠŌ£¬Óė»¹Ō¼Į”¢ÓŠ»śĪļ”¢Ņ×Č¼Īļ»ģŗĻæÉŠĪ³É±¬ÕØŠŌ»ģŗĻĪļ£¬Čē²»Ķ×ÉĘ“¦ÖĆ½«Ōģ³ÉĪ£ĻÕ”£Ņņ“ĖøĆŠ”×é¶ŌøĆ²ŠÓąĪļ½ųŠŠ·ÖĄėĢį“棬µĆµ½ĆĢĖį¼Ų¾§Ģ壬ĄūÓĆ»ŲŹÕµÄĆĢĖį¼ŲÓėÅØŃĪĖį·“Ó¦ÖĘČ”ĀČĘų£¬²¢Éč¼ĘŹµŃéŃéÖ¤ĀČĘų»ÆѧŠŌÖŹ”£
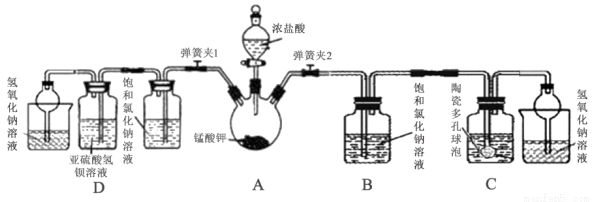
£Ø1£©“ņæŖ·ÖŅŗĀ©¶·»īČū¼°µÆ»É¼Š2£¬¹Ū²ģµ½ÉÕĘæ±ŚÓŠ×ĻŗģÉ«ĪļÖŹÉś³É²¢Öš½„ĻūŹ§£¬»ĘĀĢÉ«ĘųĢå³äĀśÉÕĘ攣·“Ó¦½įŹųŗó£¬ÉÕĘæÄŚÓŠŗŚÉ«¹ĢĢå²ŠÓą£¬Š“³ö¹ż³ĢÖŠ·¢ÉśµÄ»Æѧ·“Ó¦·½³ĢŹ½£ŗ____________”£
£Ø2£©øĆ·½·ØÖĘČ”ĀČĘų±ČÓĆ“æ¾»µÄøßĆĢĖį¼ŲŅŖ»ŗŗĶĘ½ĪČŠķ¶ą£¬ŹŌ·ÖĪöŌŅņ____________”£
£Ø3£©øĆŠ”×éĄūÓĆ×°ÖĆCĪüŹÕĀČĘųÖʱøĘÆ°×·Ū”£
¢ŁCÖŠŹ¢×°µÄŹŌ¼ĮĪŖ____________£»
¢ŚĢՓɶąæ×ĒņÅŻµÄ×÷ÓĆŹĒ____________”£
£Ø4£©²ā¶ØĘÆ°×·ŪÓŠŠ§³É·ÖµÄÖŹĮæ·ÖŹż£ŗ³ĘČ”1.5gĖłÖĘĘÆ°×·ŪÅä³ÉČÜŅŗ£¬µ÷½ŚpHÖµ²¢¼ÓČėÖøŹ¾¼Į£¬ÓĆ0.1000mol/L KIČÜŅŗ½ųŠŠµĪ¶Ø£¬Čż“ĪĘ½ŠŠŹµŃéĘ½¾łĆæ“ĪĻūŗÄ20.00mL±ź×¼ŅŗŹ±“ļµ½µĪ¶ØÖÕµć£¬·“Ó¦ŌĄķÉę¼°µ½µÄ·½³ĢŹ½ĪŖ£ŗ3ClO£+I£=3Cl£+ IO3£ £» IO3£+5I£+3H2O=6OH£+3I2
¢ŁĖłŃ”µÄÖøŹ¾¼ĮĪŖ____________£¬“ļµ½µĪ¶ØÖÕµćµÄ±źÖ¾ŹĒ____________”£
¢ŚøĆĘÆ°×·ŪÖŠÓŠŠ§³É·ÖµÄÖŹĮæ·ÖŹżĪŖ____________”£
£Ø5£©“ņæŖ·ÖŅŗĀ©¶·»īČū¼°µÆ»É¼Š1£¬æɹŪ²ģµ½DÖŠµÄĻÖĻóĪŖ____________ £¬øĆĻÖĻóÄܹ»Ö¤Ć÷ĀČĘųÓŠŃõ»ÆŠŌ”£¼×Ķ¬Ń§ČĻĪŖČ”DÖŠ·“Ó¦ŗóČÜŅŗ£¬µĪ¼ÓĻõĖįĖį»ÆµÄĻõĖįŅų£¬ČōÓŠ°×É«³Įµķ²śÉś£¬Ņ²ÄÜÖ¤Ć÷ĀČĘųŃõ»ÆĮĖŃĒĮņĖįĒā±µ£¬ÄćČĻĪŖŹĒ·ńÕżČ·²¢ĖµĆ÷ĄķÓÉ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģĮÉÄžŹ”øßČż°ĖÄ£Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )
A£®øß·Ö×Ó»ÆŗĻĪļÓĶÖ¬ŌŚČĖĢåÄŚĖ®½āĪŖøß¼¶Ö¬·¾ĖįĖįŗĶøŹÓĶµČŠ”·Ö×Ó²ÅÄܱ»ĪüŹÕ
B£®ĻÖ“śæĘ¼¼ŅŃ¾Äܹ»Åĵ½Ēā¼üµÄ”°ÕÕʬ”±£¬Ö±¹ŪµŲÖ¤ŹµĮĖĖ®·Ö×Ó¼äµÄĒā¼üŹĒŅ»øöĖ®·Ö×ÓÖŠµÄĒāŌ×ÓÓėĮķŅ»øöĖ®·Ö×ÓÖŠµÄŃõŌ×Ó¼äŠĪ³ÉµÄ»Æѧ¼ü
C£®ĪŅ¹śŅŃÄÜĄūÓĆ3D“ņÓ”¼¼Źõ£¬ŅŌīŃŗĻ½š·ŪÄ©ĪŖŌĮĻ£¬Ķعż¼¤¹āČŪ»ÆÖš²ć¶Ń»ż£¬Ą“ÖĘŌģ·É»śīŃŗĻ½š½į¹¹¼ž£¬øßĪĀŹ±æÉÓĆ½šŹōÄĘ»¹ŌĻąÓ¦µÄĀČ»ÆĪļĄ“ÖĘČ”½šŹōīŃ
D£®ÓĆ»īŠŌĢæĪŖĢĒ½¬ĶŃÉ«ŗĶÓĆ“ĪĀČĖįŃĪĘÆ°×Ö½½¬µÄŌĄķĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģ½Ī÷Ź”øßȿȫÕęÄ£ÄāĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
µžµŖĖį(HN3)Óė“×ĖįĖįŠŌĻąĖĘ£¬ĻĀĮŠŠšŹöÖŠ“ķĪóµÄŹĒ( )
A”¢HN3ÓėNH3×÷ÓĆÉś³ÉµÄµžµŖĖįļ§ŹĒ¹²¼Ū»ÆŗĻĪļ
B”¢HN3Ė®ČÜŅŗÖŠĪ¢Į£ÅØ¶Č“óŠ”Ė³ŠņĪŖ£ŗc(HN3)>c(H+)>c(N3?)>c(OH?)
C”¢NaN3Ė®ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”Ė³ŠņĪŖ£ŗc(Na+)>c(N3?) >c(OH?)>c(H+)
D”¢N3?ÓėCO2ŗ¬ĻąµČµē×ÓŹż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģŗž±±Ź”ɳŹŠ”¢É³ŹŠĪåÖŠøßæ¼Ä£ÄāĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗ¼ņ“šĢā
µŖ”¢Į×¼°Ęä»ÆŗĻĪļŌŚÉś²ś”¢Éś»īÖŠÓŠÖŲŅŖµÄÓĆĶ¾”£»Ų“šĻĀĮŠĪŹĢā£ŗ
I £Ø1£©Ö±Į“¾ŪĮ×ĖįŹĒÓÉnøöĮ×Ėį·Ö×ÓĶعż·Ö×Ó¼äĶŃĖ®ŠĪ³ÉµÄ£¬³£ÓĆÓŚÖĘČ”×čČ¼¼Į¾ŪĮ×Ėįļ§”£
¢ŁŠ“³öĮ×ĖįÖ÷ŅŖµÄµēĄė·½³ĢŹ½________________________”£
¢ŚÖ±Į“µĶ¾ŪĮ×Ėįļ§µÄ»ÆѧŹ½æɱķŹ¾ĪŖ(NH4)(n+2)PnOx£¬x=_____(ÓĆn±ķŹ¾)”£
£Ø2£©ŌŚ¼īŠŌĢõ¼žĻĀ£¬“ĪĮ×ĖįŃĪæÉÓĆÓŚ»Æѧ¶ĘŅų£¬Ķź³ÉĘä·“Ó¦µÄĄė×Ó·½³ĢŹ½”£
”õH2PO2£+”õAg++”õ______=”õPO43£+”õAg+”õ______
£Ø3£© ¹¤ŅµÉĻÉś²śĻõĖįĶ¾§ĢåµÄĮ÷³ĢĶ¼ČēĻĀ£ŗ
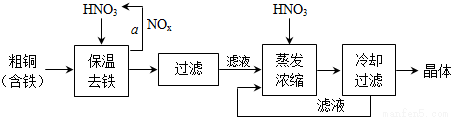
¢ŁŌŚ²½ÖčaÖŠ£¬ŠčŅŖĶØČėŃõĘųŗĶĖ®£¬ĘäÄæµÄŹĒ______£®
¢Ś½ųŠŠÕō·¢ÅØĖõŹ±£¬ŅŖÓĆĻõĖįµ÷½ŚČÜŅŗµÄpH=1£¬ĘäÄæµÄŹĒ(½įŗĻĄė×Ó·½³ĢŹ½ĖµĆ÷)______£®
¢ŪĻĀĶ¼ŹĒijŠ”×éĶ¬Ń§²éŌÄ׏ĮĻĖł»ę³öµÄĻõĖįĶ¾§Ģå[Cu(NO3)2•nH2O]µÄČܽā¶ČĒśĻß(ĪĀ¶ČŌŚ30”ęĒ°ŗó¶ŌÓ¦²»Ķ¬µÄ¾§Ģå)£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ______(Ģī×ÖÄø)£®
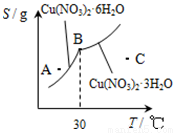
a£®AµćŹ±µÄČÜŅŗĪŖ²»±„ŗĶČÜŅŗ
b£®BµćŹ±Į½ÖÖ¾§ĢåæÉŅŌ¹²“ę
c£®°“ÉĻŹöĮ÷³Ģ×īÖÕµĆµ½µÄ¾§ĢåŹĒCu(NO3)2•3H2O
d£®Čō½«CµćŹ±µÄČÜŅŗ½µĪĀÖĮ30”ęŅŌĻĀ£¬æÉŅŌĪö³öCu(NO3)2•6H2O¾§Ģå
II £Ø4£©²éŌÄ׏ĮĻæÉÖŖ£ŗŅų°±ČÜŅŗÖŠ“ęŌŚĘ½ŗā£ŗAg+(aq)+2NH3(aq) Ag(NH3)2+(aq)£¬øĆ·“Ó¦Ę½ŗā³£ŹżµÄ±ķ“ļŹ½KĪČ[Ag(NH3)2+]= _________£¬ŅŃÖŖijĪĀ¶ČĻĀ£¬KĪČ[Ag(NH3)2+]=1.10”Į107£¬Ksp[AgCl]=1.45”Į10©10”£¼ĘĖćµĆµ½æÉÄę·“Ó¦AgCl(s)+2NH3(aq)
Ag(NH3)2+(aq)£¬øĆ·“Ó¦Ę½ŗā³£ŹżµÄ±ķ“ļŹ½KĪČ[Ag(NH3)2+]= _________£¬ŅŃÖŖijĪĀ¶ČĻĀ£¬KĪČ[Ag(NH3)2+]=1.10”Į107£¬Ksp[AgCl]=1.45”Į10©10”£¼ĘĖćµĆµ½æÉÄę·“Ó¦AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl£(aq)µÄ»ÆŃ§Ę½ŗā³£ŹżK=_________ (±£Įō2Ī»ÓŠŠ§Źż×Ö)£¬1L 1mol£ÆL°±Ė®ÖŠ×ī¶ąæÉŅŌČܽāAgCl_________mol(±£Įō1Ī»ÓŠŠ§Źż×Ö)”£
Ag(NH3)2+(aq)+Cl£(aq)µÄ»ÆŃ§Ę½ŗā³£ŹżK=_________ (±£Įō2Ī»ÓŠŠ§Źż×Ö)£¬1L 1mol£ÆL°±Ė®ÖŠ×ī¶ąæÉŅŌČܽāAgCl_________mol(±£Įō1Ī»ÓŠŠ§Źż×Ö)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğŗžÄĻŹ”øßŅ»ĻĀĘŚÖŠ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŖĖŲMµÄ×īøßÕż¼ŪŗĶøŗ¼ŪµÄ¾ų¶ŌÖµÖ®²īĪŖ6£¬M”¢NµÄĄė×Ó¾ßÓŠĻąĶ¬µÄµē×ÓÅŲ¼£¬ŌņM”¢NĖłŠĪ³ÉµÄ»ÆŗĻĪļæÉÄÜŹĒ£Ø £©
A£®MgF2 B£®MgCl2 C£®CaCl2 D£®CaBr2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğŗžÄĻŹ”ø߶žĻĀĘŚÖŠĄķæĘ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ( )
A£®½«KIŗĶFeCl3ČÜŅŗ¹÷ŗĻ£¬ČÜŅŗ±ä×Ų»ĘÉ«£¬ĖµĆ÷»¹ŌŠŌFe2+£¾I-
B£®NO2ĶØČėFeSO4ČÜŅŗÖŠµÄ¹ż³ĢÖŠÓÉĒ³ĀĢÉ«±äĪŖ»ĘÉ«
C£®ÄÜŹ¹ČóŹŖµÄµķ·ŪKIŹŌÖ½±ä³ÉĄ¶É«µÄĪļÖŹŅ»¶ØŹĒCl2
D£®SO2ĶØČėBaCl2ČÜŅŗÖŠĻČÓŠ°×É«³Įµķŗó³ĮµķČܽā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com