
放热反应CO(g)+H2O(g)
 CO2(g)+H2(g)在温度t1时达到平衡,[CO]1=[H2O]1=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为[CO]2和[H2O]2,平衡常数为K2,则( )
CO2(g)+H2(g)在温度t1时达到平衡,[CO]1=[H2O]1=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为[CO]2和[H2O]2,平衡常数为K2,则( )
A.若增大CO浓度,K2和K1都增大 B.K2>K1
C.[CO]2=[H2O]2 D.[CO]1>[CO]2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是________。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
除去乙酸乙酯中的乙酸杂质,下列方法可行的是( )
A.加乙醇、浓硫酸,加热
B.加NaOH溶液,充分振荡后,分液
C.直接分液
D.加饱和Na2CO3溶液,充分振荡后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备。
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________________。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________________。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为___________________,
该电池总反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应N2(g)+3H2(g)
 2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3属于两性氧化物
D.Al2O3能与所有的酸、碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol的镁和铝的混合物溶于100 mL 2 mol·L-1H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示:
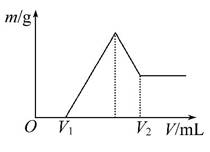
①有关反应的离子方程式为 ______________________________________。
②当V1=160 mL时,则金属粉末中n(Mg)=_________mol,V2=________mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
 的同分异构体中含有苯环的还有________种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6∶2∶2∶1的是________________________(写出其中一种的结构简式)。
的同分异构体中含有苯环的还有________种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6∶2∶2∶1的是________________________(写出其中一种的结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染,其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( )
A.锌为正极,空气进入负极反应
B.负极反应为Zn+2OH-—→ZnO+H2O+2e-
C.正极发生氧化反应
D.电解液可以是强酸也可以是强碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com