
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )
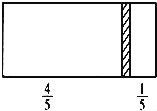
A.右边CO与CO2分子数之比为1:3
B.右侧气体密度是相同条件下氢气密度的18倍
C.右侧CO的质量为1.75g
D.若隔板处于距离右端![]() 处,其他条件不变,则前后两次压强之比为25:24
处,其他条件不变,则前后两次压强之比为25:24
【答案】D
【解析】
试题分析:当左边充入1molN2,右边充入CO和CO2的混合气体共8g,左、右室的压强相等,则右室中CO和CO2的总物质的量为1mol×![]() =0.25mol,设CO和CO2的物质的量分别为xmol、ymol,则:
=0.25mol,设CO和CO2的物质的量分别为xmol、ymol,则:![]() ,解得x=0.1875、y=0.0625.
,解得x=0.1875、y=0.0625.
A.分子数目之比等于物质的量之比;
B.根据![]() =
=![]() 计算平均摩尔质量,相同条件下气体密度之比等于其摩尔质量之比;
计算平均摩尔质量,相同条件下气体密度之比等于其摩尔质量之比;
C.根据m=nM计算CO的质量;
D.若隔板处于距离右端![]() 处,则右室气体物质的量为1mol×
处,则右室气体物质的量为1mol×![]() =0.2mol,由PV=nRT可得P=cRT,则恒温条件下压强之比等于气体总浓度之比.
=0.2mol,由PV=nRT可得P=cRT,则恒温条件下压强之比等于气体总浓度之比.
解:当左边充入1molN2,右边充入CO和CO2的混合气体共8g,左、右室的压强相等,则右室中CO和CO2的总物质的量为1mol×![]() =0.25mol,设CO和CO2的物质的量分别为xmol、ymol,则:
=0.25mol,设CO和CO2的物质的量分别为xmol、ymol,则:![]() ,解得x=0.1875、y=0.0625.
,解得x=0.1875、y=0.0625.
A.分子数目之比等于物质的量之比,右边CO与CO2分子数之比为0.187mol:0.0625mol=3:1,故A错误;
B.由此气体的平均摩尔质量为![]() =32g/mol,相同条件下气体密度之比等于其摩尔质量之比,故右侧气体密度是相同条件下氢气密度的
=32g/mol,相同条件下气体密度之比等于其摩尔质量之比,故右侧气体密度是相同条件下氢气密度的![]() =16倍,故B错误;
=16倍,故B错误;
C.CO的质量为0.1875mol×28g/mol=5.25g,故C错误;
D.由PV=nRT可得P=cRT,则恒温条件下压强之比等于气体总浓度之比,若隔板处于距离右端![]() 处,则右室气体物质的量为1mol×
处,则右室气体物质的量为1mol×![]() =0.2mol,则前后两次压强之比为
=0.2mol,则前后两次压强之比为![]() :
:![]() =25:24,故D正确,
=25:24,故D正确,
故选:D.


科目:高中化学 来源: 题型:
【题目】分某实验室需要配制480mL0.10mol/LNa2CO3溶液。
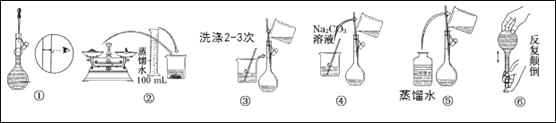
(1)实验时,应用托盘天平称取十水和碳酸钠晶体________g。
(2)所需玻璃仪器有:玻璃棒、烧杯、100mL量筒、__________、________。
(3)实验时图中所示操作的先后顺序为________ (填编号)。
(4)在配制过程中,下列操作对所配溶液浓度有无影响?__________(填“偏高”、“偏低”或“无影响”)
①称量时误用“左码右物”
②转移溶液后没有洗涤烧杯和玻璃棒
③向容量瓶加水定容时俯视液面
④摇匀后液面下降,再加水至刻度线
(5)若改用浓溶液稀释,需要量取2mol/LNa2CO3溶液____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )

A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,庚和乙形成的化合物易溶于水
D. 丁的最高价氧化物不与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【改编题】当你走进化学实验室时,首先要认真阅读并遵守《实验室安全守则》。以下实验室中的学生行为不符合实验室安全规范的是(回答两条即可):

(1)_____________________________________________________
(2)_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
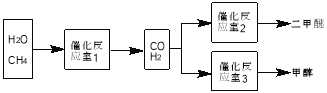
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0。将1.0molCH4和2.0molH2O通人反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=________。该反应平衡常数的表达式:_____________。
CO(g)+3H2(g) △H>0。将1.0molCH4和2.0molH2O通人反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=________。该反应平衡常数的表达式:_____________。
(2)已知:CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O(g) △H=-1323 KJ/mol;
2H2(g)+O2(g)=2H2O(g) △H=-484 KJ/mol;
CO的燃烧热:283KJ/mol。
在一定条件下,反应室2的可逆反应除生成二甲醚外还生成了气态水,该热化学方程式为_______________。(本题涉及的条件均在同一条件下)
(3) 绿色电源“二甲醚-氧气燃料电池”的工作原理如右图所示,写出X电极的电极反应式_______________
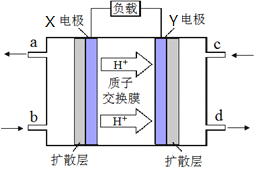
(4)反应室3中在催化剂作用下发生如下反应:CO(g) +2H2(g) ![]() CH3OH(g)。对此反应进行如下研究:
CH3OH(g)。对此反应进行如下研究:
①在容积为1L的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图1所示。
则:该正反应的△H___________0(填“<”、“>”或“=")。
②在容积均为1L的a、b、c三个相同密闭容器中分别充入1mol CO和2mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5min时甲醇的体积分数如图2所示。下列说法正确的是_______________
A.a、b、c三容器5min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c三容器中CO转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“可燃冰”是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中。据测定每0.1m3固体“可燃冰”能释放出20m3甲烷气体,则下列说法中不正确的是( )
A.“可燃冰”释放的甲烷属于烃
B.“可燃冰”的分解与释放,可能会诱发海底地质灾害,加重温室效应
C.“可燃冰”将成为人类的后续能源
D.“可燃冰”是水变的油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).
(1)实验原理:①Al4C3与硫酸反应可生成CH4;②AlN溶于强酸产生铵盐,溶于强碱生成氨气.写出Al4C3与硫酸反应的化学方程 .
(2)实验装置(如图所示):

(3)实验过程:
①连接实验装置,检验装置的气密性.称得D装置的质量为yg,滴定管的读数为amL;
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应;
③待反应进行完全后,关闭活塞K1,打开活塞K3,通过分液漏斗加入过量NaOH,与装置B瓶内物质充分反应;
④ (填入该步应进行的操作);
⑤记录滴定管的读数为bmL,称得D装置的质量为zg.
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm Lmol﹣1)
①Al4C3的质量分数为 ;
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”下同).若分液漏斗和吸滤瓶间没有用橡胶管连通,则所测气体的体积 ;
③AlN的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com