
【题目】某温度下,分别向10 mL浓度均为0.1mol/L的CuCl2和ZnCl2溶液中滴加0.1mol/L的Na2S 溶液,滴加过程中溶液中-1gc(Cu2+)和-lgc(Zn2+)与Na2S 溶液体积(V)的关系如图所示。(已知: Ksp(ZnS) > Ksp(CuS),1g3≈0.5) 下列有关说法错误的是
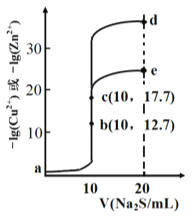
A. 溶液pH:a<b<e B. a 点的ZnCl2 溶液中: c(Cl-)<2[c(Zn2+)+c(H+)]
C. a-b-e为滴定CuCl2溶液的曲线 D. d点纵坐标小于34.9
【答案】C
【解析】A、a溶液中Zn2+和Cu2+离子水解,溶液显酸性,分别加入硫化钠生成沉淀,b点接近中性,c点为Na2S溶液,溶液显碱性,故溶液pH:a<b<e,选项A正确;B. a点的ZnCl2溶液显酸性,且存在电荷守恒有c(Cl-)=2c(Zn2+)+c(H+)-c(OH-)<2[c(Zn2+)+c(H+)],选项B正确;C、Ksp(ZnS)>Ksp(CuS),硫离子浓度相同时,-1gc(Cu2+)<lgc(Zn2+),故a-b-e为滴定Zn Cl2溶液的曲线,选项C错误;D. 10mL浓度均为0.1mol/L的CuCl2和ZnCl2溶液中滴加0.1mol/L的Na2S溶液10mL达到滴定终点,则-lgc(Zn2+)=17.7,Ksp(ZnS)=10-35.4,d点时若c(S2-)=![]() 0.1mol/L,c(Zn2+)=
0.1mol/L,c(Zn2+)=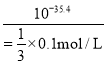 =10-34.9,故d点纵坐标小于34.9,选项D正确。答案选C。
=10-34.9,故d点纵坐标小于34.9,选项D正确。答案选C。


科目:高中化学 来源: 题型:
【题目】25℃,pH=2的两种一元酸HX、HY各取5 mL,分别加水稀释,溶液pH变化与所加水的体积关系如图所示(忽略混合溶液体积的变化),下列说法错误的是
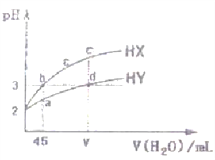
A. 分别取等体积a、b两点溶液,完全中和需同浓度NaOH溶液的体积V(HX)=V(HY)
B. b、d两点溶液中由水电离产生的H+浓度![]()
C. 相同条件下,a、b、c、d、e五点溶液的导电性大小顺序为:a>b=d>c>e
D. 加入NaOH溶液,可以使d点c(Y-)增大、c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
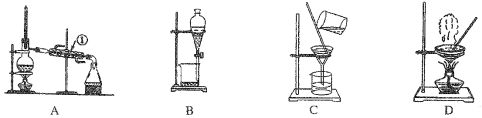
(1)从氯化钾溶液中得到氯化钾固体,选择装置___________(填代表装置图的字母,下同);除去自来水中的C1-等杂质,选择装置_____________。
(2)从碘水中分离出I2,选择装置__________,该分离方法的名称为__________________。
(3)装置A中①的名称是______________,进水的方向是从__________(填“上”或“下” )口进水。装置B在分液时为使液体顺利流下,先进行的操作是________________________________,后再打开下端活塞。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要由以下什么因素决定:( ) ①气体的分子多少 ②气体分子的大小
③气体分子间的平均距离 ④气体分子的相对分子质量.
A.①②
B.①③
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解Na2CO3溶液可制得NaHCO3和NaOH,原理如图所示。
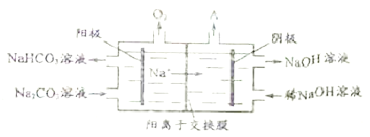
(1)阳极生成HCO3- 的电极反应式为________________________________,阴极产生的物质A的化学式为______________;
(2)工作一段时间后,两极区制得NaHCO3与NaOH的物质的量之比约为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4) 易溶于水。受热分解生成氧气。高铁酸钾的工业制法有多种,其中一种的主要步骤如图所示(方框内为主产物)。
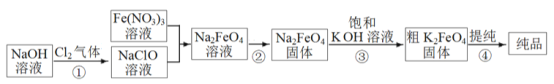
(1)①中反应的离子方程式是_____________________________。
(2)③中的反应为: Na2FeO4(s)+2KOH(aq) ![]() K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是____________;用饱和KOH 溶液的目的除了减少K2FeO4的溶解外,还有_____________。
K2FeO4(s)+2NaOH(aq),能生成高铁酸钾的可能原因是____________;用饱和KOH 溶液的目的除了减少K2FeO4的溶解外,还有_____________。
(3) 提纯粗K2FeO4采用的方法是___________________(选填“萃取”、“蒸馏”、“重结晶”)。提纯过程中溶解粗K2FeO4 固体应选用__________(填序号)。
A.水 B.稀硫酸 C.KOH 溶液 D.NaOH 溶液
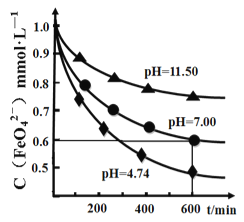
(4)某温度下,高铁酸钾溶液在不同pH 下的分解曲线如图所示。为延长高铁酸钾溶液的保存时间,可采取的措施是________________;完成pH>7 时的化学反应方程式配平:__ K2FeO4 +___=___KOH+___Fe(OH)3↓+________,____________________
(5)用高铁酸钾处理污水,能去污、杀菌、消毒,且自身被还原生成的Fe3+水解生成Fe(OH)3胶体。现用两种分别含有葡萄糖、甲苯的人工污水,每升分别加入30mg K2FeO4,相同温度下最终去除效果见下表。
项目 | 葡萄糖溶液 | 甲苯溶液 |
起始COD/(mg·L-1) | 1124 | 1966 |
处理后COD/(mg·L-1) | 983 | 526 |
去除率/% | 11.54 | 73.24 |
已知: 化学需氧量(COD) 指的是: 在一定条件下,以氧化1升水样中还原性物质所消耗的氧化剂的量为指标,折算成每升水样全部被氧化后,需要的氧气的亳克数,以mg·L-1表示。该指标也作为污水中有机物含量的综合指标之一。由甲苯引起的1L 污水,当去除率为73.24%时,理论上需高铁酸钾_____mg。[ 已知 :M(K2FeO4)=198g/mol]。理论上需要的m (Na2FeO4 ) 大于实际用量,说明Na2FeO4 去除有机污水的原理除了氧化作用外,另一个原因可能是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下可将煤转化为水煤气,水煤气可作为气体燃料,有关热化学方程式如下:
①C(s)+H2O(g)=CO(g)+H2(g) ΔH1=+131.3 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0 kJ/mol
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ/mol
下列说法正确的是
A. 煤不属于化石燃料
B. 等质量的CO和H2完全燃烧时,前者放热多
C. 水煤气作为气体燃料,比煤直接燃烧污染小
D. 由反应③可以确定H2的燃烧热为241.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在无色酸性溶液中可以大量共存的有( )
A.Ag+、K+、NO3﹣、Cl ﹣
B.K+、Cu2+、SO42﹣、HCO3﹣
C.Mg2+、Cl﹣、SO42﹣、Na+
D.CO32﹣、K+、NO3﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极都为情性电极。测得同温同压下,气体甲与气体乙的体比约为1: 2,以下说法正确的是
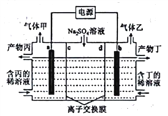
A. a极与电源的负极相连 B. 离子交换膜d为阴离子交换膜
C. 产物丙为硫酸溶液 D. 每转移0.2mol e- 则产生1.12L气体乙(标况下)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com