
| A. | 20种 | B. | 16种 | C. | 10种 | D. | 8种 |
分析 乙酸乙酯互为同分异构体的酸性物质A为丁酸,丁酸的结构有正丁酸和异丁酸,另一种物质B为戊醇,然后根据戊醇的同分异构体确定酯的同分异构体的种类.
解答 解:乙酸乙酯互为同分异构体的酸性物质A为丁酸,丁酸的结构有正丁酸和异丁酸,另一种物质B为戊醇,分子式为C5H12O醇的同分异构体:
主链五个碳的有3种:CH2(OH)CH2CH2CH2CH3、CH3CH(OH)CH2CH2CH3、CH3CH2CH(OH)CH2CH3;
主链四个碳的有4种:CH2(OH)CH(CH3)CH2CH3、CH3C(OH)(CH3)CH2CH3、CH3CH(CH3)CH(OH)CH3、CH3CH(CH3)CH2CH2(OH);
主链三个碳的有1种:C(CH3)3CH2OH
则A与B结合生成的Q的结构应有2×8=16种,
故选B.
点评 本题考查同分异构体数目的判断,掌握书写的方法是解题的关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢化物的热稳定性:D>E | |
| B. | 原子半径:A<B<C<D<E | |
| C. | B与C形成的化合物中不可能含共价键 | |
| D. | 最高价氧化物对应的水化物酸性最强的是E |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| C. | Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
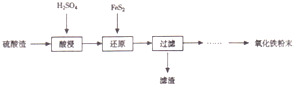
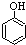 (填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O
(填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O| 沉淀物 | Fe(OH)3 | A1(0H)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | F-F | H-F | H-Cl | H-1 |
| E(kJ/mol) | 436.0 | 157 | 568 | 431.8 | 298.7 |
| A. | 表中最稳定的化学键是H-F | |
| B. | 431.8 kJ/mol>E(H-Br)>298.7 kJ/mol | |
| C. | H2(g)→2H(g)△H=+436.0 kJ/mol | |
| D. | H2(g)+F2(g)→2HF(g)△H=-25kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子或分子 | 条件 |
| ① | K+、NO3-、Cl-、HS- | c(K+)<c(Cl-) |
| ② | Cu2+、NO3-、S2-、Cl- | 滴加盐酸立即有气体产生 |
| ③ | NH4+、Fe3+、SO42-、HCOOH | 滴加NaOH浓溶液立刻有气体产生 |
| ④ | Na+、HCO3-、Mg2+、SO42- | 逐滴滴加氨水立即有沉淀产生 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com