
| 10-3(c1V1-c2V2)mol×17g/mol |
| wg |
| 10-3(c1V1-c2V2)mol×17g/mol |
| wg |
| 1.12×10-12 |
| (2.0×10-5)2 |
| ||
| ||


科目:高中化学 来源: 题型:
| A、明矾、漂白粉、臭氧的净水原理相同 |
| B、“血液透析”的原理利用了胶体的性质 |
| C、食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质 |
| D、煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
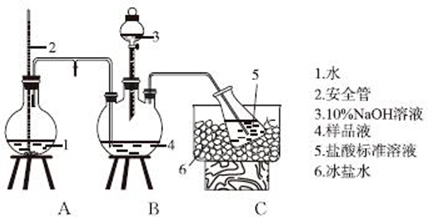
查看答案和解析>>
科目:高中化学 来源: 题型:
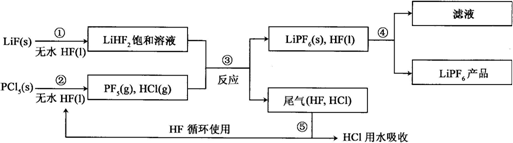
查看答案和解析>>
科目:高中化学 来源: 题型:
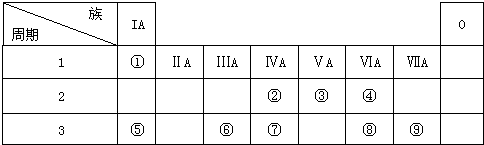
查看答案和解析>>
科目:高中化学 来源: 题型:
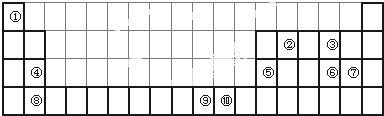
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、△H2>△H3 |
| B、△H1<△H3 |
| C、△H1+△H3=△H2 |
| D、△H1+△H2>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇稀溶液:K+、Na+、SO42-、OH- | ||
| B、氨水溶液:Mg2+、Ag+、NO3-、CH3COOH | ||
C、
| ||
| D、使石蕊变红的溶液:Fe2+、Al3+、ClO-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com