
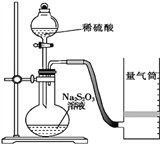
����Ŀ�������̿����Ҫ�ɷ�MnO2������SiO2 ��Fe2O3��Al2O3��Cu2(OH)2CO3�ĵ����ʣ�����ϴ������Һ����1mol/LH2SO4��FeSO4��Һ���������������̺����죨Fe2O3��������������

Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | |
��ʼ����ʱ | 8.3 | 6.3 | 4.7 | 3.4 | 2.7 |
��ȫ����ʱ | 9.8 | 8.3 | 6.7 | 4.4 | 3.2 |
��1�������ʵ����̿�ʹ��ǰ�轫����飬Ŀ����______��
��2������1�к��е���Ҫ������_______��
��3����Һ1�У��Ӱ�ˮ������ҺpH��3.2��ͨ��O2����Ӧ�����ӷ���ʽ��_______������H2O2����O2���Ƿ������������___________��
��4�����̿�������������������Һ��Ӧ�����ӷ���ʽ��_________��
��5����Һ3�м������ܵ����MnS��Ŀ���ǣ������ӷ���ʽ��ʾ��_________��
��6�����ؽᾧ������Һ4�л�ȡ�����̾���IJ����ǣ�__________��
���𰸡� ��ַ�Ӧ���ӿ췴Ӧ���� SiO2 4Fe2++O2+10H2O=4Fe(OH)3�� + 8H+ ��������Fe3+��Cu2+�Ȼ��H2O2�ֽ⣬ԭ�������ʵ� MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O MnS+Cu2+=CuS+Mn2+ �������̾�������ܽ���ȹ��ˣ�Ȼ����ȴ�ᾧ
��������(1)Ϊ������Ӵ��������߷�Ӧ���ʣ����Խ���ʯ������
(2)�������̿����������ʵijɷ֣����������ֻ��SiO2����������1�к��е���Ҫ������SiO2��
(3)�����������������ȫ��pH��֪��������Һ��pH��3.2����ʹFe3+��ȫ������ͨ��������Ϊ�˽�Fe2+����ΪFe3+�����Է�Ӧ�����ӷ���ʽ��4Fe2++O2+10H2O= 4Fe(OH)3�� + 8H+������H2O2����O2��Fe3+��Cu2+���ܴ�H2O2�ķֽ⣬���ԭ���˷ѣ�����ԭ�ϵ������ʣ����Բ�������
(4) MnO2���������ԣ�Fe2+���л�ԭ�ԣ����Է�Ӧ�����ӷ���ʽΪMnO2+2Fe2++4H+=Mn2+ +2Fe3++2H2O��
(5)�ɱ������ݿ�֪����pHΪ5ʱ��Al(OH)3������ȫ��������Һ3����Ҫ��Cu2+��Mn2+���������ܵ����MnS���ɳ�ȥCu2+����ΪCuS��MnS�����ܣ���MnS+Cu2+=CuS+Mn2+��
(6)�������̾�������ܽ���ȹ��ˣ�Ȼ����ȴ�ᾧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽����ѧ��Ӧ���ʺͻ�ѧ��Ӧ�ȵ��й����⣬ij�о�С�����������ʵ�飺
ʵ��һ��
������ͼװ�òⶨ��ѧ��Ӧ���ʣ���֪��S2O32-+2H+�TH2O+S��+SO2����
��1������ͼװ����ʾ��ʵ����Ʒ�⣬����Ҫ��һ��ʵ����Ʒ��________��
A.�¶ȼ� B.��� C.�ƾ���
��2������2minʱ�ռ���224mL��������ɱ�״�������壬�ɼ������2min��H+�ķ�Ӧ���ʣ����òⶨֵ��ʵ��ֵƫС����ԭ����__________��
ʵ�����
Ϊ̽�ַ�Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ƶ�ʵ�鷽�����±�������֪I2+2S2O32-�TS4O62-+2I-������Na2S2O3��Һ��������
ʵ����� | ���V/mL | ʱ��/s | |||
Na2S2O3��Һ | ������Һ | ��ˮ | ˮ | ||
�� | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
�� | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
�� | 6.0 | 2.0 | 4.0 | Vx | t3 |
��3������Vx=____mL��t1��t2��t3�Ĵ�С��ϵ��________��
ʵ������
ȡ5mL0.1mol/L��KI��Һ���Թ���,�μ�0.1 mol��L��1 FeCl3��Һ��Һ2mL,�������·�Ӧ��2Fe3����2I��==2Fe2����I2.Ϊ֤���÷�Ӧ�ﵽһ���������Ҿ�����,�������������ʵ�飺
��ȡ������ӦҺ,�μ�AgNO3��Һ,������������ɫ��AgI��������
����ȡ������ӦҺ,�μ�����CCl4,��,����CCl4����dz��ɫ.
���ݢ٢ڵ�����,���ǵó����ۣ��÷�Ӧ����һ���Ŀ�����,��һ�������»�ﵽ��Ӧ��.
��4��ָ����ʦָ����������ʵ���Тٲ�����,����Ϊ��ԭ����___________ ���Ľ��ķ�����__________ ��
��5��������Ϊ������ʺϼ�������I2�϶�������,����һ�ּ�㷽�����������ؼ����Ƿ�������I2,���ַ������õ��Լ���______________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaNO2)��һ�ֳ�����ʳƷ���Ӽ���ij��ȤС������ͼ��ʾװ���Ʊ�NaNO2����������������̽��(A�м���װ������ȥ)��
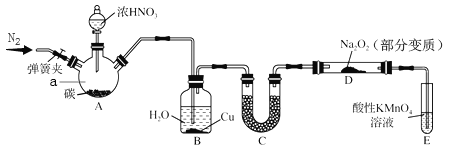
�������Ͽ�֪��
��2NO+Na2O2=2NaNO2��2NO2+Na2O2=2NaNO3��
��NO�ܱ�����KMnO4������NO3-��
�������������£�NaNO2�ܽ�I-����ΪI2��S2O32-�ܽ�I2��ԭΪI-����I2+2S2O32-=2I-+S4O62-���з�Ӧ�Ļ�ѧ����ʽ��
(1)װ��������a������Ϊ______________��A�з�Ӧ�Ļ�ѧ����ʽ��_______________��
(2)װ��B�й۲쵽����Ҫ������_____________________��
(3)װ��C��ʢ�ŵ��Լ���______________________��
(4)װ��E��������___________________��
(5)A�е���Ũ����֮ǰ��Ӧ��ͨ��N2һ��ʱ�䣬ԭ����__________________��
(6)Ϊ�ⶨ����NaNO2�Ĵ��ȣ�ȷ��ȡmgNaNO2��Ʒ������ƿ�в���������ˮ�ܽ⣬�ټ������KI��Һ�����뼸�ε�����Һ��Ȼ��μ�ϡ���ᣬ��cmol/LNa2S2O3��Һ�ζ����յ㣬�ظ�����2~3�Σ�ƽ������Na2S2O3V ml���ζ��յ��������___________________������Ʒ��NaNO2����������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���ں�CH3COOH��CH3COO-����Һ�У� CH3COOH��CH3COO-�����и�����ռ�����ʵ�������(a)����ҺpH�仯�Ĺ�ϵ��ͼ��ʾ��

����˵������ȷ����
A. ��pH<4.76����Һ�У�c(CH3COO-)<c(CH3COOH)
B. ��pH=7����Һ�У�a(CH3COOH)=0��a(CH3COO-)=1.0
C. ��pH>4.76����Һ�У�c(CH3COO-)��c(OH-)֮�Ϳɴ���c(H+)
D. ��pH=4.76����Һ�м����ᣬa(CH3COOH)��a(CH3COO-)֮�ͱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ʒ��ڻ�ѧѧϰ�о�������,�������ƵĽ�����ȷ����()
A. ��Cl2+2KBr�T2KCl+Br2����F2Ҳ����KBr��Һ��Ӧ�û���Br2
B. �����£���Cu+4HNO3��Ũ���TCu(NO3)2+2NO2��+2H2O������FeҲ����Ũ���ᷴӦ����NO2
C. ��Cu+Cl2![]() CuCl2����Cu+I2
CuCl2����Cu+I2![]() CuI2
CuI2
D. ���Ʊ�����ú���У����Լ�Ҳ���Ա�����ú����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����У�û�з�����ѧ�仯���ǣ� ��
A.���ȷ�ӦB.Һ��ӷ�C.Ũ������ˮD.�⻯���ֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ��Ȼ���ʱ���������ַ��������ý���������ֱ�ӻ����Ƶã����ý��������ᷴӦ�Ƶã����������ַ��������Ƶõ��Ȼ����ǣ� ��
A.AlCl3
B.FeCl3
C.FeCl2
D.CuCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���Ԫ�ء���Ԫ�ؼ��仯��������ʾ�����Ҫ����
��1����NH4A1(SO4)2������ˮ�����ñ�Ҫ�Ļ�ѧ���P����˵����������_________��
����ͬ�����£�0.1mol NH4A1(SO4)2��Һ�е�c(NH4+��______������ڡ���С�ڡ����ڡ���0.1mol��L-1NH4HSO4��Һ�е�c��NH4+����
��2��25�棬��0.10mol��L-1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c(S2-)��ϵ��ͼ��������Һ����ı仯��H2S�Ļӷ�����

��pH=13ʱ����Һ�е�c(H2S)+c(HS-)=_____mol��L-1.
��ij��Һ��0.020 mol��L-1Mn2+��0.10 mol��L-1H2S������ҺpH=______ʱ��Mn2+��ʼ������[��֪��Ksp(MnS)=2.8��10-13]
��3��25�棬������ĵ���ƽ�ⳣ�����ұ���
Ka1 | Ka2 | |
H2SO3 | 1.3��10-2 | 6.3��10-4 |
H2CO3 | 4.2��10-7 | 5.6��10-11 |
��HSO3-�ĵ���ƽ�ⳣ������ʽK=______��
��0.10 mol��L-1Na2SO3��Һ������Ũ���ɴ�С��˳��Ϊ_____��
��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������480mL0.1mol��L��1������ͭ��Һ����ѡȡ500mL����ƿ�������ƣ����²�����ȷ����( )
A.��ȡ7.68g����ͭ�����500mL��Һ
B.��ȡ12.0g����������500mLˮ
C.��ȡ8.0g����ͭ������500mLˮ
D.��ȡ12.5g���������500mL��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com