
| A. | K+、Cu2+、NO3-、OH- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | Fe3+、K+、NO3-、SO42- |
分析 A.铜离子与氢氧根离子反应生成氢氧化铜沉淀;
B.四种离子之间不反应,为澄清透明溶液;
C.银离子与氯离子之间反应生成氯化银沉淀;
D.四种离子之间不发生反应,能够共存.
解答 解:A.Cu2+、OH-之间反应生成难溶物氢氧化铜,在溶液中不能大量共存,故A错误;
B.K+、Na+、Cl-、NO3-之间不发生反应,在溶液中能够大量共存,故B正确;
C.Ag+、Cl-之间反应生成氯化银沉淀,在溶液中不能大量共存,故C错误;
D.Fe3+、K+、NO3-、SO42-之间不反应,在溶液中能够大量共存,故D正确;
故选BD.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436 | 243 | 431 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
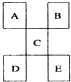
| A. | D一定足金属元素,其金属性比C强 | |
| B. | C的最高价氧化物水化物显强酸性 | |
| C. | E的原子序数一定是A的5倍,且原予半径比A大 | |
| D. | B的氢化物是以分子形式存在,且分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大N2的浓度可使该反应的反应速率加快 | |
| B. | 升高温度,该反应的反应速率加快 | |
| C. | 将1 mol N2和3 mol H2混合进行反应,反应完成时得到2 mol NH3 | |
| D. | 单位时间内生成1 mol N2,同时消耗3 mol H2,说明该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
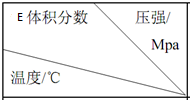 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 915℃,2.0 MPa 时 E 的转化率为 60% | |
| B. | K(810℃)>K(1000℃) | |
| C. | 该反应可在较低温度下自发进行 | |
| D. | e>d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com