
某合金中铜和铁的物质的量均为0.3mol,将其全部投入b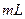 4
4  的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。学科网
的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。学科网
(1)若金属有剩余,其质量为 g,在溶液中再滴人稀硫酸后,剩余金属为
g,在溶液中再滴人稀硫酸后,剩余金属为 g,则
g,则 与
与 的关系为:
的关系为:
 (填“>”、“<”或“=”)。 学科网
(填“>”、“<”或“=”)。 学科网
(2)若b=450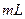 ,则溶液中的金属阳离子为 。
,则溶液中的金属阳离子为 。
(3)若合金与硝酸溶液恰好反应完全,求b的取值范围(要有计算过程)
(1)>(2分)
(2) 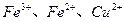 (2分)
(2分)
(3)有关反应为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O……(1)
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4 H2O……(2)
Fe+4 HNO3=Fe(NO3)3+ NO↑+2H2O……(3)学科网
根据方程式(1)计算,0.3 mol Cu需要硝酸0.8 mol。学科网
如硝酸不足按方程式(2)计算,0.3 mo1 Fe需要硝酸0.8 mol
需要硝酸l.6 mol,且b="400" mL(2分)
如果硝酸充足则按方程式(3)计算,0.3 mol Fe需要硝酸 l.2mol学科网
共需硝酸2 mol,则b =" 500" mL(2分)
所以400 mL≤b≤500mL。(1分)学科网
解析


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
某合金中铜和铁的物质的量均为0.3mol,将其全部投入b![]() 4
4![]() 的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
(1)若金属有剩余,其质量为![]() g,在溶液中再滴人稀硫酸后,剩余金属为
g,在溶液中再滴人稀硫酸后,剩余金属为![]() g,则
g,则![]() 与
与![]() 的关系为:
的关系为:![]()
![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)若b=450![]() ,则溶液中的金属阳离子为 。
,则溶液中的金属阳离子为 。
(3)若合金与硝酸溶液恰好反应完全,求b的取值范围(要有计算过程)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省高三上学期期中考试化学卷 题型:填空题
某合金中铜和铁的物质的量均为0.3mol,将其全部投入b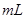 4
4
 的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
(1)若金属有剩余,其质量为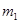 g,在溶液中再滴人稀硫酸后,剩余金属为
g,在溶液中再滴人稀硫酸后,剩余金属为 g,则
g,则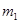 与
与 的关系为:
的关系为: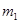
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)若b=450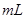 ,则溶液中的金属阳离子为
。
,则溶液中的金属阳离子为
。
(3)若合金与硝酸溶液恰好反应完全,求b的取值范围(要有计算过程)
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com