
分析 (1)根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积.
(2)溶液配制的一般操作步骤有:计算、称量(量取)、溶解(稀释)、移液、洗涤移液、定容、摇匀等操作,根据配制溶液的实验操作过程选择所需的仪器;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰.
解答 解:(1)浓H2SO4的物质的量浓度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=100mL×1mol/L,解得:x≈5.4.故所需浓硫酸的体积为5.4mL;
答:需取用98%的浓硫酸5.4mL;
(2)溶液配制一般步骤是:计算→称量(量取)→溶解(稀释)、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量(用量筒量取),在烧杯中溶解(稀释),并用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,
所以需要的仪器为:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,量取5.4mL溶液应选择10mL量筒,
用不到的仪器:A 100mL量筒 C 50mL容量瓶;
故选:A、C;
(3)A.所用的浓硫酸长时间放置在密封不好的容器中,导致浓硫酸浓度降低,量取浓硫酸中硫酸的物质的量偏小,溶液浓度偏小;
故答案为:偏小;
B.容量瓶用蒸馏水洗涤后残留有少量的水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度无影响,
故答案为:无影响;
C.所用过的烧杯、玻璃棒未洗涤,导致溶质的物质的量偏小,溶液浓度偏小;
故答案为:偏小;
D.定容时俯视溶液的凹液面,导致溶液体积偏小,溶液浓度偏大;
故答案为:偏大;
(4)在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰.即先加盐酸酸化,无现象,再加氯化钡溶液,出现白色沉淀,说明含有SO42-;
故答案为:取瓶中少量的溶液于试管中,先加入足量的盐酸,再加入氯化钡溶液有白色沉淀产生,说明含有SO42-.
点评 本题考查了一定物质的量浓度溶液的配制,硫酸根离子的检验,明确配制原理及操作步骤是解题关键,注意硫酸根离子检验应先排除杂质离子干扰.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
| A. | 两者均有丁达尔效应 | B. | 两者均能透过半透膜 | ||
| C. | 分散质粒子可通过滤纸 | D. | 加入盐酸先沉淀,随后溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、SO32- | B. | K+、Na+、NO3-、SO42- | ||
| C. | K+、NH4+、NO3-、SO42- | D. | K+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 1mol/L FeCl3溶液中,阴、阳离子总数大于0.4NA | |
| C. | 12g金刚石中所含的C-C键数为2NA | |
| D. | 18g的D2O与NA个CH3-具有相同的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐既可以做调味剂,又可以做防腐剂 | |
| B. | 纯碱既可以做清洗品,又可以做发酵粉 | |
| C. | 漂白粉既可以做消毒剂,又可以做漂白剂 | |
| D. | 酒精既可以做饮料,又可以做燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸雕刻玻璃:Si+4HF═SiF4↑+2H2↑ | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉或漂粉精长期暴露在空气中会变质:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO 2HClO=2 HCl+O2↑ | |
| B. | FeCl3溶液中加入铁粉,震荡后滴入几滴KSCN溶液,未见溶液变红:2Fe3++Fe═3 Fe2+ | |
| C. | 把水加入盛有过氧化钠固体的试管中,放出气体,可使带火星的木条复燃:2Na2O2+2 H2O═4 NaOH+O2↑ | |
| D. | 溶质物质的量之比为1:2的明矾溶液与 Ba(OH)2溶液混合,生成白色沉淀:Al3++2SO42-+2Ba2++4 OH-═2 BaSO4↓+Al(OH)3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
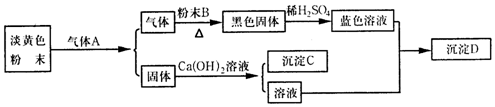
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
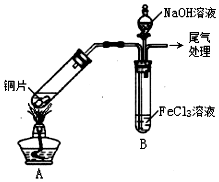 某化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去)
某化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com