
���ع��͡�����Ϊ������ȼ�ϡ�����ȼ�������������ܡ���֪�����ʵ���Ҫת��;������Ҫ��������ͼ��ʾ�������й�������ȼ���Լ��������ܵ�˵������ȷ���ǣ� ��
������ȼ�ϱ�����������Դ��̫���ܡ�������ά��ˮ���õ��Ҵ������������ܡ����������ѽ��õ����͡����͵����ڴ��������ֲ��ոѵȷ��ͻ�õ���������Ҫ�ɷ��Ǽ��顡����������Դ��һ����ȾС�Ŀ�������Դ
| A���٢ڢۢܢ� | B���٢ڢܢ� |
| C���ۢܢ� | D���٢ڢۢ� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪������������ȼ��ʱ������ɫ���棬�ڷ�Ӧ�����У��ƻ�1 mol�����Ļ�ѧ�����ĵ�����ΪQ1 kJ���ƻ�1 mol�����Ļ�ѧ�����ĵ�����ΪQ2kJ ���γ�1 mol�Ȼ����еĻ�ѧ�����ĵ�����ΪQ3kJ�����й�ϵʽ��ȷ���� �� ��
| A��Q1 + Q2 > Q3 | B��Q1 + Q2 > 2Q3 | C��Q1 + Q2 < Q3 | D��Q1+ Q2 < 2Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪ H2(g) +Cl2(g) =2HCl(g)��Ӧ�ų�����ΪQ1��H2(g) +Br2(g)= 2HBr(g)��Ӧ�ų�����ΪQ2�й�������Ӧ��������ȷ���ǣ� ��
| A��Q1<Q2 |
| B�������������������ڷ�Ӧ�������� |
| C������1 mol HCl����ʱ�ų�Q1���� |
| D��1 mol HBr(g)�����������1 mol HBr(l)������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ڻ�ѧ��Ӧ�е������仯������ȷ����
| A���γ��»�ѧ���Ĺ��̻�ų����� | B���кͷ�Ӧ�����ȷ�Ӧ |
| C�����Ȳ��ܷ����ķ�Ӧ�����ȷ�Ӧ | D������CO2�ķ�Ӧ�Ƿ��ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
N2H4��һ�ָ�Ч���Ļ��ȼ�ϡ�0.25 mol N2H4(g)��ȫȼ�����ɵ�������̬ˮʱ���ų�133.5 kJ�������������Ȼ�ѧ��������ȷ����
A��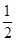 N2H4(g)+ N2H4(g)+ 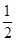 O2(g)�� 1/2 N2(g)+ H2O(l)��H=+257kJ��mol��1 O2(g)�� 1/2 N2(g)+ H2O(l)��H=+257kJ��mol��1 |
| B��N2H4(g)+O2(g)��N2(g)+2H2O(l)��H����133.5kJ��mol��1 |
| C��N2H4(g)+O2(g)��N2(g)+2H2O(g)��H��+534kJ��mol��1 |
| D��N2H4(g)+O2(g)��N2(g)+2H2O(g)��H����534kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������һ����Դ��������Ҫ�ɷ���CH4��0��5molCH4��ȫȼ������CO2��Һ̬ˮʱ�ų�445kJ���������������Ȼ�ѧ����ʽ����ȷ����
| A��2CH4(g) + 4O2(g) =2CO2(g) + 4H2O(l) ��H����890kJ��mol��1 |
| B��CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ��H����890kJ��mol��1 |
| C��CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ��H����890kJ��mol��1 |
| D��1/2CH4(g) + O2(g) =1/2CO2(g) + H2O(l) ��H����890kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪�����£�N2(��)��H2(��)����2mol NH3(��)�ų�92.4 kJ���������мס��������ݻ���ͬ�Һ��ݵ��ܱ��������ڳ����£������ܱ���������ͨ��1 molN2��3 mol H2���ﵽƽ��ʱ�ų�����Q1kJ�������ܱ���������ͨ��0.5 mol N2��1.5 mol H2���ﵽƽ��ʱ�ų�����Q2kJ�������й�ϵʽ��ȷ����( )
| A��Q1=2Q2=92.4 | B��92.4 >Ql>2Q2 | C��92.4=Q1>2Q2 | D��92.4 >Q1=2Q2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���б仯�������ȷ�Ӧ���� �� ��
��Һ̬ˮ����
�ڽ��������ȱ�Ϊ��ɫ��ĩ
��Ũ����ϡ��
������طֽ�������
����ʯ�Ҹ�ˮ��Ӧ������ʯ��
��Ba(OH)2��8H2O��NH4Cl������
| A���٢ܢ� | B���٢ڢ� | C���٢ڢ� | D���ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ȼ��һ�����Ķ�������ų�������ΪQ����ȫ���������ɵ�CO2�����������Σ���5 mol��L��1��NaOH��Һ100 mL�������ȼ����Ϊ( )
| A��16Q | B��8Q | C��4Q | D��2Q |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com