
| A. | 1L0.1mol/L盐酸和1L0.1mol/L硫酸分别与1L2mol/LNaOH溶液反应的反应速率相同 | |
| B. | 化学反应速率为0.8mol/(L•s),其含义是时间为1s时,某物质的浓度是0.8mol/L | |
| C. | 等体积的0.1mol/L盐酸和0.1mol/L硝酸与形状和大小相同的大理石反应的速率相同 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 |
分析 A.同浓度的盐酸和硫酸的氢离子浓度不同;
B.化学反应速率为0.8mol/(L•s),含义为单位时间内浓度变化0.8mol/L;
C.浓度相同,固体表面积相同,则反应速率相同;
D.反应速率大小与反应现象没有必然的联系.
解答 解:A.同浓度的盐酸和硫酸的氢离子浓度不同,则与等浓度的氢氧化钠反应的速率不同,故A错误;
B.化学反应速率为“0.8mol/(L•s)”表示的意思是:时间段为1s时,某物质的浓度增加或减少0.8mol/L,故B错误;
C.等体积的0.1mol/L盐酸和0.1mol/L硝酸浓度相同,大理石固体表面积相同,则反应速率相同,故C正确;
D.反应速率快的现象不一定明显,如NaOH与HCl的反应,反应速率慢的现象可能明显,如铁生锈,故D错误.
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,注意外界条件对活化分子的影响,难度不大.


科目:高中化学 来源: 题型:解答题
浓度/mol/L 时间/min | 0 | 10 | 20 | 30 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 |
| N2 | 0 | 0.21 | 0.30 | 0.30 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32.0g | B. | 16.0 | C. | 18.0 | D. | 36.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向鸡蛋清的溶液中加入浓的硫酸铵溶液,蛋白质的性质发生改变并凝聚 | |
| B. | 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,下层析出肥皂 | |
| C. | 油脂为髙分子化合物,分子结构中都含有酯基 | |
| D. | 纤维素、麦芽糖在一定条件下均可转化为葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和液氯是两种不同的物质 | |
| B. | NH3是电解质,所以氨水能导电 | |
| C. | 氨不能用浓硫酸干燥,但可以用无水CaCl2干燥 | |
| D. | 新制的氯水呈酸性,向其中滴加几滴紫色石蕊试液并振荡,溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰、冰水共存物、烧碱、小苏打 | |
| B. | 同素异形体:活性炭、C60、石墨烯、金刚石 | |
| C. | 非电解质:氨气、二氧化硫、铜、乙醇 | |
| D. | 混合物:铝热剂、纯净矿泉水、分析纯盐酸、漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
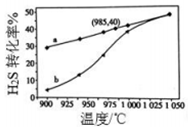 废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.
废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应中维生素C作催化剂 | |
| B. | 因为河虾中含有砷元素,所以不能食用 | |
| C. | 砒霜是砷的氧化物,由上述可推知砒霜中含有的砷是+3价 | |
| D. | 上述反应中维生素C作氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com