
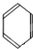
 、
、 五种烃,
五种烃,| y |
| 4 |
 、
、 的(x+
的(x+| y |
| 4 |
 耗氧量最多;
耗氧量最多; 、
、 五种烃中,碳原子数最少的是CH4,则等物质的量时CH4生成二氧化碳的量最少;
五种烃中,碳原子数最少的是CH4,则等物质的量时CH4生成二氧化碳的量最少; 、
、 五种烃中,H原子数最少的是CH≡CH,则等物质的量时CH≡CH生成水的量最少;
五种烃中,H原子数最少的是CH≡CH,则等物质的量时CH≡CH生成水的量最少; ;CH4;CH≡CH;
;CH4;CH≡CH; 、
、 中C、H原子数目之比分别为1:4、1:2、1:1、1:1、7:8,故甲烷中H元素质量分数最大,则等质量时甲烷消耗氧气最多、生成水的质量最大、生成二氧化碳的量最少,而乙炔、
中C、H原子数目之比分别为1:4、1:2、1:1、1:1、7:8,故甲烷中H元素质量分数最大,则等质量时甲烷消耗氧气最多、生成水的质量最大、生成二氧化碳的量最少,而乙炔、 分子中含氢量最小,等质量时耗氧量最小,
分子中含氢量最小,等质量时耗氧量最小, ;CH4;CH4;
;CH4;CH4; 、
、 五种烃中,CH2=CH2、CH≡CH能够与溴水反应,CH2=CH2、CH≡CH、
五种烃中,CH2=CH2、CH≡CH能够与溴水反应,CH2=CH2、CH≡CH、 能够与酸性高锰酸钾溶液反应,而甲烷不能与液溴发生反应,只有
能够与酸性高锰酸钾溶液反应,而甲烷不能与液溴发生反应,只有 在铁做催化剂条件下与液溴发生取代反应生成溴苯,
在铁做催化剂条件下与液溴发生取代反应生成溴苯, ;
; 能够与酸性高锰酸钾溶液反应,CH2=CH2、CH≡CH能够与溴水反应,
能够与酸性高锰酸钾溶液反应,CH2=CH2、CH≡CH能够与溴水反应, 和CH4在任何条件下都不能与溴水及酸性KMnO4溶液反应,
和CH4在任何条件下都不能与溴水及酸性KMnO4溶液反应, 、CH4;
、CH4; 能够与酸性高锰酸钾溶液反应,CH4、
能够与酸性高锰酸钾溶液反应,CH4、 不与溴水反应,则不与溴水反应但与酸性KMnO4溶液反应的是
不与溴水反应,则不与溴水反应但与酸性KMnO4溶液反应的是 ,
, .
.


科目:高中化学 来源: 题型:
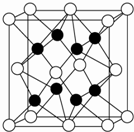 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
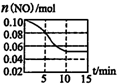 汽车尾气中含有NO和CO等有害气体.选择适当的催化剂可将CO、NO转化为无毒气体.
汽车尾气中含有NO和CO等有害气体.选择适当的催化剂可将CO、NO转化为无毒气体.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
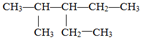 的名称是
的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
| 共价键 | H-H | Cl-Cl | Br-Br | H-Cl | H-I | I-I | N≡N | H-O | H-N |
| 键能 | 436 | 247 | 193 | 431 | 299 | 151 | 946 | 463 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用50mL0.25mol/L H2SO4与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.
用50mL0.25mol/L H2SO4与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com