
【题目】下列反应中属于水解反应的是( )
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
D.CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
【答案】C
【解析】
水解反应是在酸性或碱性条件下,水与另一化合物反应,该化合物分解为两部分,水中的H+加到其中的一部分,而羟基(-OH)加到另一部分,因而得到两种或两种以上新的化合物的反应过程,据此可判断分析。
A.CH2=CH2+H2O![]() CH3CH2OH中,H2O直接与双键发生加成反应,不是水解反应,A选项错误;
CH3CH2OH中,H2O直接与双键发生加成反应,不是水解反应,A选项错误;
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O为氧化还原反应,没有发生水解反应,B选项错误;
2CH3CHO+2H2O为氧化还原反应,没有发生水解反应,B选项错误;
C.CH3CH2Br+NaOH![]() CH3CH2OH+NaBr反应中,CH3CH2Br分解成—CH2CH3和—Br,水中的H+与—Br结合生成HBr,—CH2CH3与—OH形成CH3CH2OH,HBr与NaOH反应生成NaBr,满足条件,是水解反应,C选项正确;
CH3CH2OH+NaBr反应中,CH3CH2Br分解成—CH2CH3和—Br,水中的H+与—Br结合生成HBr,—CH2CH3与—OH形成CH3CH2OH,HBr与NaOH反应生成NaBr,满足条件,是水解反应,C选项正确;
D.CH3COOH+C2H5OH![]() CH3COOC2H5+H2O为酯化反应,D选项错误;
CH3COOC2H5+H2O为酯化反应,D选项错误;
答案选C。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】利用印刷电路板的废腐蚀液(含CuCl2、FeCl2 和FeCl3)回收制备CuCl22H2O和Fe2O3,的过程如下,下列说法错误的是( )
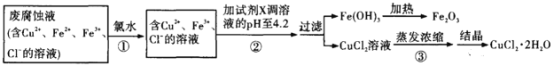
A.步骤①加入氯水的目的是将Fe2+转化成Fe3+
B.步骤②加入的试剂X可为铜粉
C.步骤③蒸发浓缩时滴加浓盐酸,目的是抑制CuCl2水解
D.Fe2O3可用作红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00 mol CO2和2.00 mol H2以及催化剂发生反应:CO2(g)+H2(g) ![]() HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
实验编号 | 时间/min | 60 | 90 | 120 | 150 | 180 |
Ⅰ | T1/K | 1.50mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
Ⅱ | T2/K | 1.45mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)实验I中0~60min内用HCOOH表示的该反应的平均反应速率为____________。
(2)实验II反应开始时体系压强为P0,第90min时体系压强为P1,则P1:P0=_______。
(3)T2温度下反应的平衡常数为______________。
(4)比较实验温度T1____T2(填“>”或“<”),该反应的△H____0(填“>”、“=”或“<”)。
(5)下列说法正确的是_______(填编号)。
A.当CO2、H2和HCOOH的物质的量浓度之比为1:1:1时,该反应达到平衡
B.容器中气体密度不再改变,不能判断该反应是否达到平衡
C.将HCOOH液化后分离既能提高转化率又能加快反应速率
D.选用更高效的催化剂可提高生产效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O,下列说法正确的是 ( )
8Na2CrO4+2Fe2O3+8CO2,②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O,下列说法正确的是 ( )
A. 反应①和②均为氧化还原反应
B. 反应①的氧化剂是O2,还原剂是FeO·Cr2O3
C. 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D. 反应①中每生成1 mol Na2CrO4时转移电子3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O。将12g该有机物的完全燃烧产物通过浓硫酸,浓硫酸增重14.4g,再通过碱石灰,碱石灰增重26.4g。则该有机物的分子式为( )
A.C4H10B.C2H6OC.C3H8OD.C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为___。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
I0/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | … |
则该元素的元素符号是___。
(4)NO3-的空间构型__(用文字描述),SO42-中硫原子的杂化方式为___。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___、中心原子的杂化形式为___。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___。
(6)与O3分子互为等电子体的一种阴离子为___(填化学式)。
(7)N2分子中σ键与π键的数目比n(σ):n(π)=___。
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是___(用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为___g/cm3(用含a、NA的式子表示)。
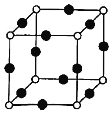
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.2 molL-1的碳酸钠溶液250 mL。
(1)根据计算需取___________克无水碳酸钠固体
(2)需要使用的主要仪器有托盘天平,____________、____________、_____________、____________和___________;
(3)下列操作对所配制溶液的浓度有何影响(填偏高、偏低或无影响)
①碳酸钠固体未充分干燥______________;
②容量瓶用碳酸钠溶液洗涤_____________;
③转移溶液时容量瓶中有少量的蒸馏水__________;
④定容时仰视读数_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com