
| ||
| ||


科目:高中化学 来源: 题型:
| 序号 | 实验步骤 | 现象 | 探究目的和结论 |
| ① | 将刚削皮的苹果立刻放入隔绝空气的环境中 | 相当长一段时间内,无明显变化 | |
| ② | 将刚削皮的苹果立刻放入90℃~95℃的水中2min,再放在空气中. 再将另一块刚削皮的苹果立刻放入稀盐酸中浸泡2min后取出洗净,再放在空气中.将盐酸改为酒精、醋酸铅溶液进行相同实验. | 相当长一段时间内,均无明显变化 | |
| ③ | 在刚削皮的苹果上滴加FeCl3溶液. | 苹果由白色变为绿色 | 探究目的:探究苹果中是否含有酚类物质.结论:苹果中含有酚类物质. |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.0001mol/L的HCl |
| B、0.00001mol/L的H2SO4 |
| C、0.0000001mol/L的NaOH |
| D、纯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
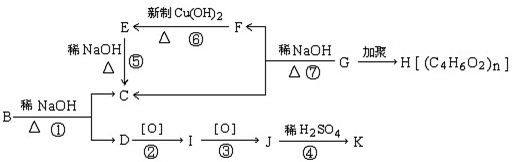
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
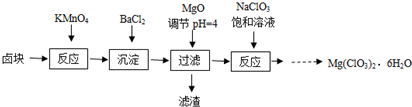
| A、卤块中加入KMnO4发生的氧化还原反应有2个 |
| B、加入BaCl2为沉淀SO42- |
| C、也可用Mg(OH)2代替MgO调节溶液的PH |
| D、在滤液中加NaClO3饱和溶液得到产品利用了相同温度下Mg(ClO3)2溶解度比NaClO3小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
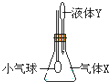 如图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y不可能是( )
如图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y不可能是( ) | A | B | C | D | |
| 气体X | NH3 | SO2 | CO2 | HCl |
| 液体Y | 水 | 浓NaOH | 稀H2SO4 | 食盐水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com