
| A、10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| B、1molFe与过量的稀HNO3反应,转移的电子数为2 NA |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D、一定温度下,l L 0.50 mol?L-1NH4C1溶液与2 L0.25mol?L-1NH4C1溶液NH4+的离子数均为0.5NA |


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、第一步反应的离子方程式为ClO-+2I-+2H+═I2+Cl-+H2O |
| B、淀粉KI溶液变蓝是因为I-被氧化为I2,淀粉遇I2变蓝色 |
| C、蓝色逐渐消失的原因是Na2SO3溶液具有漂白性 |
| D、微粒的氧化性由强到弱的顺序是ClO->I2>SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
c(N
| ||
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li | B、Na | C、K | D、Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ |
| 0.1mol?L-1 CH3COOH 溶液 | pH=12 NaOH溶液 | 0.1mol?L-1 NaOH 溶液 | pH=2 CH3COOH 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
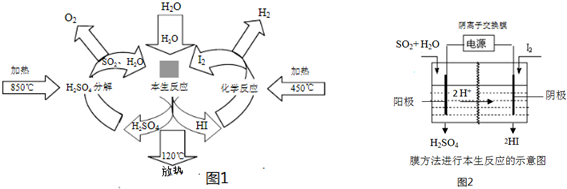
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com