
| A. | 元素周期律是按相对原子质量逐渐增大的顺序从左到右排列的 | |
| B. | 最外层电子数相同的元素都是同一族 | |
| C. | 同周期元素原子的电子层数相同数一定相同 | |
| D. | 非金属元素的最外层电子数都大于或等于4 |
分析 A.元素周期律是原子结构周期性变化的结果;
B.He与Mg的最外层电子数相同;
C.电子层数=周期数;
D.一般非金属元素的最外层电子数都大于或等于4,H的最外层电子数为1.
解答 解:A.元素周期律是原子结构周期性变化的结果,则元素周期律是按原子序数逐渐增大的顺序从左到右排列的,故A错误;
B.He与Mg的最外层电子数相同,不在同族,故B错误;
C.电子层数=周期数,则同周期元素原子的电子层数相同数一定相同,故C正确;
D.一般非金属元素的最外层电子数都大于或等于4,H的最外层电子数为1,故D错误;
故选C.
点评 本题考查周期表的结构与应用,为高频考点,把握元素的位置、性质及应用、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
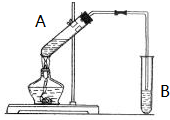 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)>c(Na+)+c(H+) | |
| B. | 由水电离出的c(OH-)=1.0×10-2mol﹒L-1 | |
| C. | 与等体积pH=2的醋酸混合后所得溶液显碱性 | |
| D. | 与等体积0.01mol﹒L-1氯化铵溶液混合后所得溶液中:c(Na+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2CO3、NaHCO3两溶液中,离子种类不相同 | |
| B. | 在NaHCO3溶液中有c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) | |
| C. | 在Na2CO3溶液中有c(OH-)=c(H+)+c(HCO3-)+2 c(H2CO3) | |
| D. | 在Na2CO3溶液中有2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| C | ||
| A | R | B |
| D |
| A. | 4 Z | B. | 4 Z+10 | C. | 4 Z+5 | D. | 4 Z+14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和稀硝酸都具有氧化性 | B. | 铜与硝酸的反应属于置换反应 | ||
| C. | 硝酸可氧化Fe2+ | D. | 可用铁或铝制品盛装浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| c(I-)/mol•L-1 | c(Fe3+)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉密封保存,因为潮湿条件下易于CO2反应 | |
| B. | 光导纤维是将太阳能直接转化为电能的常见材料 | |
| C. | 用氢氟酸蚀刻玻璃和用FeCl3溶液蚀刻铜值线路板,均属于氧化还原反应 | |
| D. | 家用消毒柜中通过高压放电使空气产生少量臭氧,这一过程属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
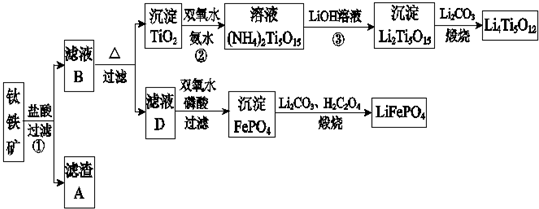
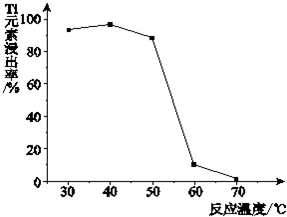
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com