
【题目】(1)已知某反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。
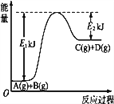
该反应是____(填“吸热”或“放热”)反应,该反应的ΔH=_____ kJ· mol-1(用含E1、E2的代数式表示)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l) =H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式___________________________。
(3)已知:H2(g)+Cl2(g)==2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为______kJ。
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________。
【答案】 吸热 E1-E2 CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1 434 kJ SO3(g)+H2O(l)===H2SO4(l) ΔH=-130 kJ·mol-1
【解析】(1)由图象可知,反应物的能量低于生成物的能量,所以该反应是吸热反应;ΔH= E1—E2 kJ· mol-1;
(2) 燃烧热是1mol燃烧物完全燃烧生成稳定的化合物所释放的热量,所以①×1/2-②×2即得CH3OH(l)+3/2O2(g)==CO2(g)+2 H2O(l) ΔH=—725.8 kJ·mol-1;
(3) ΔH=反应物键能总和—生成物键能总和,所以ΔH=-185 kJ/mol=436 kJ/mol+247 kJ/mol-2E(H—Cl),所以E(H—Cl)==434 kJ/mol,即形成1 mol H—Cl键放出的能量为434 kJ;
(4)根据盖斯定律可推知, ![]() [③—①—②×2],即得SO3(g)+H2O(l)==H2SO4(l) ΔH=
[③—①—②×2],即得SO3(g)+H2O(l)==H2SO4(l) ΔH=![]() [H3—ΔH1—ΔH2×2]= —130 kJ·mol-1。
[H3—ΔH1—ΔH2×2]= —130 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】(1)某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。
限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、MnSO4、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
①写出上述反应的离子方程式:________________________。
②上述实验①②是探究____________对化学反应速率的影响;上述实验②④是探究____________对化学反应速率
影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为______________;表格中的“乙”填写t/s,其测量的是______________________。
③实验①中对“乙”重复测量三次,所得数值分别13.6,13.5,13.4。忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___________ 。
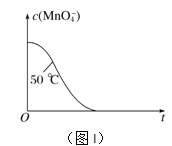
④已知实验①50℃时c(MnO![]() )~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO
)~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO![]() )~t的变化曲线示意图。______________
)~t的变化曲线示意图。______________
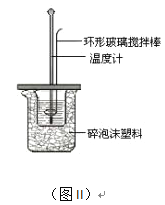
(2)测定中和热的实验装置如图II所示。
①写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式_______________________(中和热数值为57.3 kJ/mol):
②取60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.9 | |
2 | 26.2 | 26.4 | 26.3 | 30.6 | |
3 | 25.9 | 25.9 | 25.9 | 29.5 | |
4 | 26.4 | 26.2 | 26.3 | 30.0 | |
近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=________________________kJ/mol(列出计算式)。
③能引起中和热偏高的原因是(填字母)__________。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.用50mL0.50mol/L醋酸代替了硫酸进行反应,
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
E. 量取硫酸溶液的体积时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
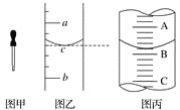
【题目】(1)图甲是实验室常用的一种仪器,其名称是________;其主要用途是________;
(2)小明用某规格的量筒量取一定体积的液体,液面位置如图乙,则其量得液体体积为___或__(用a、b来表示)。
(3)图丙表示10 mL量筒中液面的位置,A与B、B与C刻度相差1 mL,如果刻度A为5,量筒中液体体积是________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图,下列说法正确的是
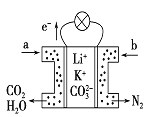
A. 正极电极反应式为O2+2CO2+4e-=2CO32- B. CO32-向正极移动
C. 此电池在常温时也能工作 D. a为CH4,b为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家发现,普通盐水在无线电波的照射下可以燃烧,这一发现将有望解决未来人类的能源危机。无线电频率可以降低盐水中所含原子之间的结合力,释放出氢原子,一旦点火,氢原子就会在这种频率下持续燃烧。上述“结合力”的实质是( )
A.共价键B.离子键C.静电斥力D.静电引力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
某化学兴趣小组将上述流程②、③设计成如下图所示操作。

已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①____________,③____________。
(2)在灼烧过程中,使用到的实验仪器有酒精灯、____________、____________(除泥三角外)。
(3)F中下层液体的颜色为________色,上层液体中溶质的主要成分为____________。
(4)从F中得到固态碘还需进行的操作是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法中不正确的是( )
A. 在粗硅的提取中发生反应2C+SiO2![]() 2CO+Si,硅元素被还原
2CO+Si,硅元素被还原
B. 太阳能电池可采用硅材料制作,其应用有利于环保、节能
C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D. 由Na2CO3+SiO2![]() CO2+Na2SiO3可知硅酸的酸性强于碳酸
CO2+Na2SiO3可知硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式是H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)Na2A溶液显_________(填“酸性”“中性”或“碱性”)。理由是__________(用离子方程式表示)。
(2)已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中c(H+ )_______(填“<”“>”或“=”)0.11mol/L。
(3)在0.1mol/L的Na2A溶液中,下列微粒浓度关系式不正确的是__(填字母)。
A.c(A2- )+c(HA-)=0.1mol/L
B.c(OH-)=c(H+) +c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(4)若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com