研究CO、SO
2、NO等大气污染气体的综合处理与利用具有重要意义.
(1)以CO或CO
2与H
2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)
.
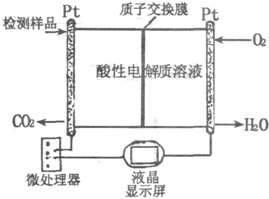
(2)右图所示是用于合成甲醇产品中甲醇含量的检测仪.写出该仪器工作时的电极反应式:
负极
,正极
.
(3)一定条件下,NO
2和SO
2反应生成SO
3(g)和NO两种气体,现将体积比为1:2的NO
2和SO
2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
.(填序号)
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO
3、NO的体积比保持不变D.每消耗 1mol SO
2,同时生成1mol NO当测得上述平衡体系中NO
2与SO
2体积比为1:6时,则该反应平衡常数K值为
;
(4)工业常用Na
2CO
3饱和溶液回收NO、NO
2气体:NO+NO
2+Na
2CO
3═2NaNO
2+CO
2 2NO
2+Na
2CO
3═NaNO
3+NaNO
2+CO
2若用足量的Na
2CO
3溶液完全吸收NO、NO
2混合气体,每产生标准状况下CO
2 2.24L(CO
2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO
2体积比为
.

 研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义.
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义. SO3(g)+NO(g)
SO3(g)+NO(g)

 名校课堂系列答案
名校课堂系列答案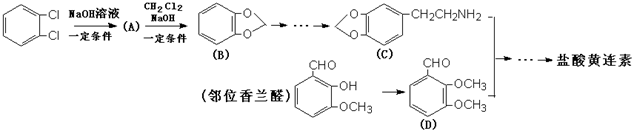

 +HCl
+HCl
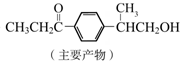
 与1分子
与1分子  也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为