
【题目】0.1mol/L的NH4Cl溶液中,离子浓度关系正确的是
A.c(![]() )>c(Cl—)>c(H+)>c(OH—)
)>c(Cl—)>c(H+)>c(OH—)
B.c(![]() )>c(OH—)>c(Cl—)>c(H+)
)>c(OH—)>c(Cl—)>c(H+)
C.c(OH—)=c(Cl—)+c(H+)
D.c(![]() )+c(H+)=c(Cl—)+c(OH—)
)+c(H+)=c(Cl—)+c(OH—)
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】某卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子和少量的尿素[CO(NH2)2].利用该卤块为原料生产轻质氧化镁的工艺流程如图:

当相关金属离子[c0(Mn+)=0.1molL﹣1]时,形成氢氧化物沉淀的pH范围如表:
金属离子 | Fe2+ | Fe3+ | Mn2+ | Mg2+ |
开始沉淀的pH | 7.6 | 2.7 | 8.3 | 9.6 |
沉淀完全的pH | 8.3 | 3.7 | 9.8 | 11.1 |
回答下列问题:
(1)NaClO中氯元素的化合价为_____。NaClO为漂白液的主要成分,写出制备漂白液的离子方程式_____。
(2)若溶液b中杂质离子的浓度均为0.1molL﹣1,若要使杂质离子沉淀完全,步骤③应溶液的pH调节至_____,沉淀物A含有Mn(OH)2和_____。
(3)若在实验室中完成步骤⑥,则沉淀物C应在_____(填仪器名称)中灼烧。写出步骤⑥的化学方程式_____。
(4)步骤②加入NaClO还能除去卤块中的尿素[CO(NH2)2],生成一种盐和两种无毒气体及水,其化学方程式为_____,若除去卤快中含有的0.02molCO(NH2)2,需消耗NaClO的质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
A. 等于1.8 s B. 等于1.2 s C. 大于1.8 s D. 小于1.8 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是
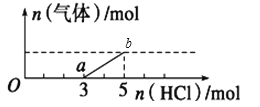
A.O点溶液中所含溶质的化学式为NaOH、Na2CO3
B.a点溶液中能使酚酞溶液变红
C.标准状况下,通入CO2的体积为44.8L
D.原NaOH溶液的物质的量浓度为5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( )
2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( )
A.容器内的压强不再改变B.c(SO2):c(O2):c(SO3)=2:1:2
C.SO2的转化率不再改变D.SO3的生成速率与SO3的消耗速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、银和金是日常生活中常用金属
(1)基态铜原子的价层电子排布式为___________。
(2)银氨溶液主要成分是[Ag(NH3)2]OH,配制方法是,向AgNO3溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液
①AgNO3中阴离子的空间构型是_______________;
②[Ag(NH3)2]+中银离子的配位数为___________;NH3分子中N的杂化类型是__________。
③与NH3互为等电子体的离子有_____________。
(3)现代工业冶金中,2Au(CN)![]() +Zn=2Au+Zn(CN)
+Zn=2Au+Zn(CN)![]() 。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
(4)铜、银是有机反应常见的催化剂如CH3CH2OH![]() CH3CHO+H2O。CH3CH2OH的沸点高于CH3CHO的主要原因是_____________________________________________。
CH3CHO+H2O。CH3CH2OH的沸点高于CH3CHO的主要原因是_____________________________________________。
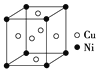
(5)一种铜镍合金(俗称白铜)的晶胞如图所示,铜、镍原子个数比为___________。
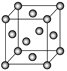
(6)金晶胞如图所示,这种晶体堆积方式称为___________堆积。该晶胞中原子空间利用率(φ)为___________ (用含π的式子表示),(提示原子空间利用率=![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
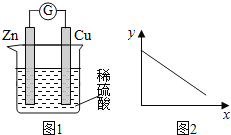
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是
A. T2时,CH4的平衡转化率为30.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com