
有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素。A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标况下的密度为0.759g/L,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族。均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:
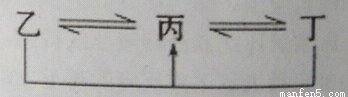
(1)单质B 的结构式: 。
(2)F元素周期表中的位置: 。
(3)均含有F元素的乙与丁在溶液中发生反应的离子方程式 。
均含有D元素的乙与丁在溶液中发生反应的离子方程式 。
(4)由A、C元素组成的化合物庚和A、E元素组成的化合物辛,相对分子质量均为34.其中庚的熔沸点比辛 (填“高”或“低”),原因是 。
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:2016届浙江省嘉兴、杭州、宁波五校高三上第一次联考化学试卷(解析版) 题型:推断题
(I)A、B、C、D、E为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在C中充分燃烧能生成其最高价化合物BC2。D+与C2-具有相同的电子数。A在E中燃烧,产物溶于水得到一种强酸。回答下列问题:(1)B在元素周期表中的位置是 ,写出一种工业制备单质E方法的离子方程式 。(2)这五种元素两两之间能形成多种化合物,请写出A2C和DA相互反应的化学方程式
(II)化合物甲由四种元素组成,撞击甲容易发生爆炸生成三种物质,产物之一是纯净固体单质乙,另两种产物丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一,3.0g甲发生爆炸反应,生成2.16g乙和标准状况下0.224L丁,其余为丙.回答下列问题:
(1)丁的结构式
(2)甲发生爆炸反应的化学方程式为
(3)已知化合物甲中,有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,
爆炸反应中氧化产物与还原产物的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中文化学试卷(解析版) 题型:?????
下列物质中属于油脂的是( )
A. 甘油 B. 润滑油 C. 汽油 D. 花生油
查看答案和解析>>
科目:高中化学 来源:2016届浙江临海台州中学高三上学期第三次统练化学试卷(解析版) 题型:选择题
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示
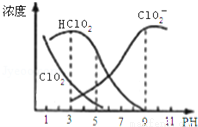
(Cl﹣没有画出).则下列分析正确的是
A.亚氯酸钠在酸性条件下较稳定
B.25℃时,HClO2的电离平衡常数的数值Ka=10﹣6
C.pH越大,该漂白剂的漂白性能越好
D.25℃,pH=3时,NaClO2溶液中:c(Na+)+(H+)=c(ClO2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016届四川成都第七中学高三阶段测试三理综化学试卷(解析版) 题型:实验题
最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图:


已知:正丁醇沸点118℃,纯邻苯二甲酸二丁酯是无色透明、具有芳香气味的油状液体,沸点340℃,酸性条件下,温度超过180℃时易发生分解。
由邻苯二甲酸酐、正丁醇制备邻苯二甲酸二丁酯实验操作流程如下:
① 向三颈烧瓶内加入30g(0.2mL)邻苯二甲酸酐,22g正丁醇以及少量浓硫酸。
② 搅拌,升温至105℃,持续搅拌反应2小时,保温至反应结束。
③ 冷却至室温,将反应混合物倒出,通过工艺流程中的操作X,得到粗产品。
④ 粗产品用无水硫酸镁处理至澄清→取清液(粗酯)→圆底烧瓶→减压蒸馏,经过处理得到产品20.85g。
请回答以下问题:
(1)步骤②中不断从分水器下部分分离出产物水的目的是 。判断反应已结束的方法是 。
(2)上述实验可能生成的副产物的结构简式为 (填一种即可)
(3)操作X中,应先用5%碳酸钠溶液洗涤粗产品,纯碱溶液浓度不宜过高,更不能使用氢氧化钠;若使用氢氧化钠溶液,对产物有什么影响?(用化学方程式表示) 。
(4)操作X中,分离出产物的操作中必须使用的主要玻璃仪器有 。
(5)粗产品提纯流程中采用减压蒸馏的目的是 。
(6)本实验中,邻苯二甲酸二丁酯(式量是278)的产率为 。
查看答案和解析>>
科目:高中化学 来源:2016届山西平遥中学等重点中学高三第三次练兵化学试卷(解析版) 题型:选择题
四种短周期元素在周期表中的位置如图,其中只有M元素最外层电子数与电子层数相等,下列说法不正确的是
Y | Z | ||
M | X |
A.原子半径Z<M
B.非金属性:X<Z
C.M元素最高价氧化物对应水化物具有两性
D.Y的最高价氧化物对应的水化物的酸性比X的弱
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第五次月考理化学试卷(解析版) 题型:选择题
某恒温密闭容器中,可逆反应A(s)  B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.若开始时向容器中加入1molB和1molC,达到平衡时放出热量等于Q kJ
D.保持体积不变,向平衡体系中加入A,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第五次模拟理科综合试卷(解析版) 题型:填空题
铝是人类生活中继铜、铁之后又一个重要的金属。工业上冶炼金属铝的原料来源于自然界中重要的矿物质钒土(主要成分:Al2O3;还有SiO2、Fe2O3、FeCO3、MgCO3等杂质)。从钒土中提取得到Al2O3的工艺流程如下图所示:
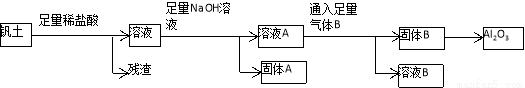
请回答下列问题:
(1)固体A所含物质的化学式(或分子式)是_____________________________。
(2)写出溶液A与气体B反应的离子方程式________________________________。
(3)工业冶炼金属铝通常用石墨碳块作电解槽的阳极,请你根据电解原理解释电解冶炼铝过程中,需要定期补充阳极碳块的原因____________________________。
(4)Al2O3的熔点很高,因而在工业冶炼时,需将Al2O3的熔于熔化的冰晶石(Na3AlF6)中进行电解。有一位同学查阅资料发现,AlCl3的熔点很低。他提出:可通过电解熔融状态的AlCl3制取金属铝。你认为他提出的方案是否可行?为什么?______________________________________________。
(5)另一位同学分析了“从钒土中提取Al2O3的工艺流程”后指出:可以从“溶液B”中分离得到另一个重要的化工产品——小苏打。根据这位同学的想法,如果不考虑生产过程的损耗,请你计算每生产10.0t金属铝,理论上可得到小苏打产品___________t。
查看答案和解析>>
科目:高中化学 来源:2015-2016北京大学附中宇华教育集团高二12月化学卷(解析版) 题型:选择题
在2A(g)+B(g)=3C(g)+4D(g)中,表示该反应速率最快的是( )
A.v(A )=0.5mol•L﹣1.mim﹣1
)=0.5mol•L﹣1.mim﹣1
B.v( B)=0.3mol•L﹣1.mim﹣1
B)=0.3mol•L﹣1.mim﹣1
C.v(C)=0.8mol•L﹣1.mim﹣1
D.v(D)=1.0mol•L﹣1.mim﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com