
| A. | △H1+△H2-△H3 | B. | 2△H1+△H2+△H3 | ||
| C. | △H1+0.5△H2+△H3 | D. | △H1+0.5△H2+0.5△H3 |
分析 燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量,根据盖斯定律来回答.
解答 解:已知:①C(s)+H2O(l)=CO(g)+H2(g);△H1=+175.3kJ•mol-1
②2CO(g)+O2(g)=CO2(g);△H2=-566.0kJ•mol-1
③2H2(g)+O2(g)=2H2O(l);△H3=-571.6kJ•mol-1
则化学方程式C(s)+O2(g)=CO2(g)可以看成是[2×①+②+③]×$\frac{1}{2}$得到的,所以该反应的焓变△H=△H1+$\frac{△{H}_{2}+△{H}_{3}}{2}$,即为C(s)的燃烧热.
故选D.
点评 本题考查学生燃烧热的概念以及盖斯定律的应用知识,注意知识的迁移和应用是关键,难度不大.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:解答题
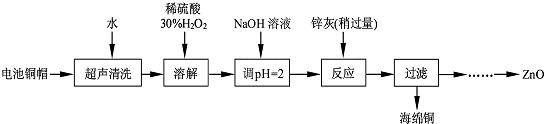
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、H+、NO3-、Na+ | B. | OH-、K+、NO3-、Cl- | ||
| C. | Mg2+、H+、OH-、SO42- | D. | Na+、Cu2+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①⑤ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA | |
| B. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| C. | 标准状况下,11.2L SO3 中含有2NA个原子 | |
| D. | 用石灰乳完全吸收1 mol Cl2时,转移电子的数目是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为8NA | |
| C. | 0.5 摩1,3-丁二烯分子中含有C=C双键数为 NA | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ||||||
| 4 | ⑧ | ⑨ | ||||||
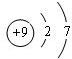 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=3.0×10-8 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在任何条件下,纯水都呈中性 | |
| B. | 电离平衡常数Ka越小,表示弱电解质电离能力越强 | |
| C. | 为保存FeCl3溶液,要在溶液中加少量硫酸 | |
| D. | 明矾溶液蒸干得到的固体为Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com