
【题目】室温下,同种规格的铝片分别与下列物质混合,产生氢气速率最大的是
A. 0.1 mol/L的盐酸15mL B. 0.15 mol/L的硫酸溶液8mL
C. 0.4 mol/L的硝酸12mL D. 18 mol/L的浓硫酸15mL
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧,取焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
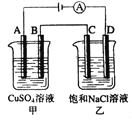
A. 甲烧杯中A极上最多可析出铜0.64g
B. 甲烧杯中B极上电极反应式4OH--4e-= 2H2O+O2↑
C. 乙烧杯中滴入酚酞试液,D极附近先变红
D. 烧杯中C极上电极反应式为4H+ + 4e-=2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
2 | C | N | O | |||||
3 | Na | Mg | Si | S | Cl | Ar | ||
4 | Ca |
(1)化学性质最不活泼的元素是 (填元素名称);
(2)N原子结构示意图为 ;Ca的最外层电子数为 .
(3)第
(4)C、N和O原子半径由小到大的顺序的是 ;
(5)第2周期中气态氢化物最稳定的是 ;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是 (写出一种).
(7)海洋是大自然赐予人类的宝物.从中可以提取的第一大类物质是 该物质的焰色反应为 色,它暴露在空气中易潮解是因为还含有 .
(8)Na、Al最高价氧化物的水化物之间反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有灼烧了一段时间的碳酸钙样品16g,将其溶于足量的水中,向其中通入适量的二氧化碳,过滤,再次将所得的固体灼烧至质量不变,所得固体质量11.2g,则原固体混合物中钙元素的质量分数为 ()
A.50%B.40%C.60%D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.钢铁发生吸氧腐蚀的正极反应式:O2+4e-+2H2O=4OH-
D.用铁作电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A.被氧化的砒霜为1.98 mg
B.分解产生的氢气为 0.672 mL
C.和砒霜反应的锌为3.90 mg
D.生成砷化氢时,转移的电子总数为6×10-5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,其中电极I为Al,其它均为Cu,下列说法正确的是( )

A. 装Al2(SO4)3溶液的烧杯是原电池,其余两个为电解(电镀)池
B. 盐桥中电子从右侧流向左侧
C. 电极II逐渐溶解
D. 电极IV的电极反应:Cu2+ + 2e-= Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____ ___。
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_____ __。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是____ __。
(4)丙组同学取10 mL0.1mol/L KI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二只试管中加入1滴K3Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____________(填离子符号);实验①和③说明:在I- 过量的情况下,溶液中仍含有 ___(填离子符号),由此可以证明该氧化还原反应为___ ___。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______ _;一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__ ____;生成沉淀的原因是____ __(用平衡移动原理解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com