
| A、①④ | B、②③ | C、③④ | D、①③ |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、④ | B、② | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量的金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ |
| B、铝片投入稀盐酸中:Al+6H+═Al3++3H2↑ |
| C、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-═BaSO4↓ |
| D、氧化铝溶于烧碱溶液:Al2O3+2OH-═AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| M |
| A、X可用新制的氢氧化铜检验 |
| B、反应X→Y中,1molX可生成3molY |
| C、由Y生成乙酸乙酯的反应属于取代反应 |
| D、可用碘的四氯化碳溶液检验淀粉是否水解完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取8.58mL蒸馏水 |
| B、将氢氧化钠固体直接放在称量纸上称量 |
| C、中和滴定时,滴定管用蒸馏水洗净后直接装入标准盐酸溶液 |
| D、不慎将苯酚溶液沾到皮肤上,立即用酒精清洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫酸铝溶液中加入过量的氨水:Al3++4NH3?H2O═AlO
| ||||
| B、澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-=CaCO3↓+H2O | ||||
C、铁片放入过量的稀硝酸中:3Fe+8H++2NO
| ||||
D、偏铝酸钠与过量盐酸反应:AlO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Na2O2固体中含离子总数为4NA | ||
| B、标准状况下,22.4L己烷中共价键数目为19NA | ||
| C、由乙烯和环己烷组成的混合物28g,含电子数为16NA | ||
D、1L浓度为1mol/L的Na2CO3溶液中含有的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
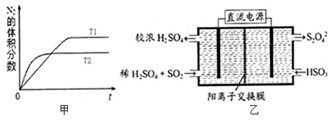 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com