
分析 (1)SO2被Na2SO3溶液吸收生成亚硫酸氢钠;
(2)根据Ka越大酸性越强,根据酸性较强的能与酸性较弱的酸根离子反应;
(3)根据电离和水解程度的相对大小分析;既电离又水解,以电离为主,溶液显酸性;
(4)+4价的硫元素能被氧气氧化为+6价;
(5)根据过量NaHSO3溶液的还原性和I2的氧化性能继续发生氧化还原反应来分析反应产物;
(6)依据选项中的溶液性质和二氧化硫反应的过程和化学方程式定量关系分析计算.
解答 解:(1)SO2被Na2SO3溶液吸收生成亚硫酸氢钠,离子反应为SO32-+SO2+H2O=2HSO3-,
故答案为:SO32-+SO2+H2O=2HSO3-;
(2)已知Ka越大酸性越强,酸性较强的能与酸性较弱的酸根离子反应,由于HCO3-的酸性小于HSO3-的酸性,所以HCO3-与SO32-不反应,即bc能共存,
故答案为:bc;
(3)HSO3-在溶液中电离出氢离子,同时HSO3-能水解,由于电离程度大于水解程度,所以溶液显酸性;HSO3-既电离又水解,以电离为主,溶液显酸性,则溶液中的离子浓度大小关系为:Na+>HSO3->H+>SO32->OH-;
故答案为:亚硫酸氢根的电离程度大于水解程度;Na+>HSO3->H+>SO32->OH-;
(4)+4价的硫元素能被氧气氧化为+6价,则亚硫酸氢钠溶液放置在空气中一段时间,会被空气中的氧气氧化,其反应的离子方程式为:2HSO3-+O2=2SO42-+2H+;
故答案为:2HSO3-+O2=2SO42-+2H+;
(5)NaIO3溶液中滴加过量NaHSO3溶液时,I2能与NaHSO3发生氧化还原反应,碘元素的化合价降低,则还原产物为NaI,
故答案为:NaI;
(6)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是
a.Na2SO3 吸收二氧化硫发生的反应为:Na2SO3+SO2+H2O=2NaHSO3,1molNa2SO3 最多吸收二氧化硫1mol;
b.Na2S 吸收二氧化硫发生的反应为:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,1mol2Na2S最多反应二氧化硫2.5mol;
c.酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5;
则吸收二氧化硫理论吸收量由多到少的顺序是c=b>a,
故答案为:c=b>a.
点评 本题考查了硫元素及其化合物的性质,题目难度中等,题目涉及元素化合物的性质、盐的水解原理的应用、电离常数的应用、离子浓度大小比较等,侧重于考查学生的分析能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质:水溶液是否导电 | |
| B. | 原子晶体:构成晶体的微粒是否是原子 | |
| C. | 共价分子:分子中原子间是否全部是共价键 | |
| D. | 化学平衡状态:平衡体系中各组分的物质的量浓度是否相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
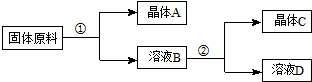
| A. | ①和②的实验过程中,都需要控制温度 | |
| B. | ①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| C. | ②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| D. | 用95%的酒精洗涤所得的硝酸钾晶体比较好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先通过足量澄清石灰水,再通过足量品红溶液 | |
| B. | 先通过足量饱和NaHCO3溶液,再通过澄清石灰水 | |
| C. | 先通过足量NaOH溶液,再通过澄清石灰水 | |
| D. | 先通过足量酸性KMnO4溶液,再通过澄清石灰水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com