
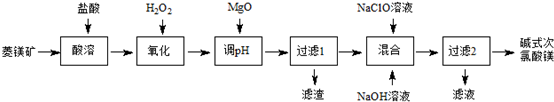
分析 菱镁矿含少量FeCO3,用盐酸溶解,所得溶液中含有MgCl2、FeCl2及过量的HCl,再加入过氧化氢将Fe2+氧化为Fe3+,加入MgO调节溶液pH,Fe3+使转化为Fe(OH)3沉淀过滤除去,滤液为MgCl2溶液,向MgCl2溶液中加入NaClO溶液、NaOH溶液得到[Mg2ClO(OH)3•H2O],过滤分离,滤液中含有NaCl.
(1)酸溶时,矿石需进行粉碎且盐酸过量,提高镁的浸取率;
(2)过氧化氢将Fe2+氧化为Fe3+;
(3)用KSCN溶液检验溶液中是否含有铁离子;
(4)开始加入氢氧化钠或氢氧化钠过量,会生成Mg(OH)2沉淀;过滤2的滤液中含有氯化钠;
(5)碱式次氯酸镁中含有次氯酸根,具有强氧化性.
解答 解:菱镁矿含少量FeCO3,用盐酸溶解,所得溶液中含有MgCl2、FeCl2及过量的HCl,再加入过氧化氢将Fe2+氧化为Fe3+,加入MgO调节溶液pH,Fe3+使转化为Fe(OH)3沉淀过滤除去,滤液为MgCl2溶液,向MgCl2溶液中加入NaClO溶液、NaOH溶液得到[Mg2ClO(OH)3•H2O],过滤分离,滤液中含有NaCl.
(1)酸溶时,矿石需进行粉碎且盐酸过量,增大接触面积、提高化学反应速率、使反应完全,提高镁的浸取率,
故答案为:提高镁的浸取率;
(2)过氧化氢将Fe2+氧化为Fe3+,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)过滤1是除去氢氧化铁,杂质离子未除尽,滤液中含有Fe3+,用KSCN溶液检验溶液中是否含有Fe3+,
故答案为:KSCN溶液;
(4)开始加入氢氧化钠或氢氧化钠过量,会生成Mg(OH)2沉淀,故混合时NaOH溶液需最后加入且不能过量,过滤2的滤液中含有氯化钠,通过加热浓缩、冷却结晶、过滤、洗涤、干燥可以获得NaCl,
故答案为:防止生成Mg(OH)2沉淀;NaCl;
(5)碱式次氯酸镁中含有次氯酸根,具有强氧化性,可以杀菌消毒,
故答案为:碱式次氯酸镁具有强氧化性.
点评 本题考查物质制备实验、物质分离和提纯、对操作与原理的分析评价等,明确工艺流程原理是解本题关键,熟练掌握元素化合物知识,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 3m+n | B. | $\frac{5}{2}$m+$\frac{1}{2}$n-p | C. | $\frac{5}{2}$m+$\frac{1}{2}$n | D. | 3m+n+2p |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶于水:NaHCO3═Na++H++CO32- | |
| B. | H2CO3?2H++CO32- | |
| C. | Al(OH)3酸式电离:Al(OH)3═H2O+AlO2-+H+ | |
| D. | NaHSO4熔化:NaHSO4═Na++HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NaClO | C. | NaCl | D. | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com