
 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:| A. | 前5min反应的平均速率v(N2O4)=0.36mol•(L•min)-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 反应①、②均为吸热反应 | |
| D. | 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
分析 A、根据化学反应速率v=$\frac{△c}{△t}$来计算化学反应速率;
B、化学平衡常数K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$,代入相关数据来计算即可;
C、根据温度对化学平衡移动的影响:升高温度,化学平衡向着吸热方向进行,反之向着放热方向进行,据此来判断反应的吸放热;
D、根据转化率=$\frac{变化量}{初始量}$来计算即可.
解答 解:A、前5min反应的平均速率v(N2O4)=$\frac{△c}{△t}$=$\frac{0.9mol/L}{5min}$=0.18mol•(L•min)-1,故A错误;
B、T1℃时反应②的化学平衡常数K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.9}{1.{5}^{2}}$=0.4L/mol,故B错误;
C、在该题中,升高温度后,二氧化氮的浓度增加,四氧化二氮的浓度减小,所以平衡②逆向移动,该反应是放热的,故C错误;
D、若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,则Qc=0.31<K,所以反应正向进行,T1℃达到平衡时,
2NO2(g)?N2O4(g)
初始:1.8 1.0
变化:2x x
平衡:1.8-2x 1.0+x
则$\frac{1.0+x}{(1.8-2x)^{2}}$=0.4,解得x=0.1,即N2O4的转化率为10%,故D正确.
故选D.
点评 本题考查学生化学反应速率和化学平衡的有关计算知识,属于综合知识的考查,注意知识的归纳和整理是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2═HCOONa+H2O.储氢、释氢过程均无能量变化 | |
| B. | 2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的热效应相同 | |
| C. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 | |
| D. | 过程N2(g)-→2N(g)放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgF2 | B. | CaCl2 | C. | K2S | D. | Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ①④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
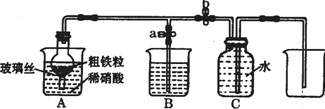 (1)如图所示是实验室中制取气体的一种简易装置.
(1)如图所示是实验室中制取气体的一种简易装置.| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-x-2}{W-m}$ mol | B. | $\frac{W(m-x)}{m}$ mol | C. | $\frac{W(m-x-2)}{m}$mol | D. | $\frac{W(m-x+2)}{m}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
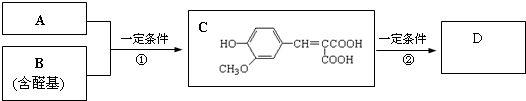
 .
.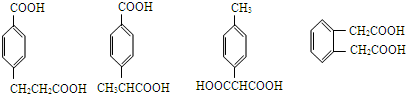 任意一种.
任意一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com