
ij¶žŌŖČõĖį£Ø¼ņŠ“ĪŖH2A£©ČÜŅŗ£¬°“ĻĀŹ½·¢ÉśŅ»¼¶»ņ¶ž¼¶µēĄė£ŗ
H2A 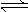 H++HA-£¬HA-
H++HA-£¬HA- 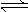 H++A2-
H++A2-
ŅŃÖŖĻąĶ¬ÅØ¶ČŹ±µÄµēĄė¶Č¦Į(H2A)>¦Į(HA-)£¬ÉčÓŠĻĀĮŠĖÄÖÖČÜŅŗ£ŗ
A”¢0.01mol/LµÄH2AČÜŅŗ
B”¢0.01mol/LµÄNaHAČÜŅŗ
C”¢0.02mol/LµÄHClÓė0.04mol/LµÄNaHAČÜŅŗµČĢå»ż»ģŗĻ
D”¢0.02mol/LµÄNaOHÓė0.02mol/LµÄNaHAČÜŅŗµČĢå»ż»ģŗĻ
¾Ż“Ė£¬ĢīŠ“ĻĀĮŠæÕ°×£ØĢī“śŗÅ£©£ŗ
£Ø1£©c(H+)×ī“óµÄŹĒ £¬×īŠ”µÄŹĒ £»
£Ø2£©c(H2A)×ī“óµÄŹĒ £¬×īŠ”µÄŹĒ £»
£Ø3£©c(A2-)×ī“óµÄŹĒ £¬×īŠ”µÄŹĒ ”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠø÷ĻīĖµ·Ø²»ŹĒFe(OH)3½ŗĢåĢŲÓŠµÄŠŌÖŹµÄŹĒ£Ø””””””””””£©
£Į£®Fe(OH)3½ŗĢåĮ£×ÓĖł×÷µÄ²¼ĄŹŌĖ¶Æ””””””””””””
£Ā””ŌŚµē³”×÷ÓĆĻĀ£¬Fe(OH)3½ŗĢåĮ£×ÓŌŚ·ÖÉ¢¼ĮĄļ×÷¶ØĻņŅʶÆ
£Ć£®µ±¹āŹųĶعżFe(OH)3½ŗĢåŹ±£¬æÉŅŌ擵½Ņ»Ģõ¹āĮĮµÄ”°ĶØĀ·”±
£Ä£®ĻņFe(OH)3½ŗĢåÖŠÖšµĪ¼ÓČėŃĪĖįŹ±»į¹Ū²ģµ½Ļȱä»ė×ĒŌŁ±ä³ĪĒ唣
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ
A£®0.1mol NH3ČÜÓŚ×ćĮæĖ®ÖŠ(²»æ¼ĀĒ°±Ęų»Ó·¢)£¬ČÜŅŗÖŠNŌ×ӵďżÄæĪŖ0.1NA
B£®±ź×¼×“æöĻĀ£¬22.4LNOÓėCO2µÄ»ģŗĻĘųĢåÖŠŗ¬ÓŠOŌ×ÓŹżĪŖ3NA
C£®0.1molN2Óė×ćĮæµÄH2·“Ó¦£¬×ŖŅʵĵē×ÓŹżŹĒ0.6NA
D£®58.5 gµÄNaCl¹ĢĢåÖŠŗ¬ÓŠNAøöĀČ»ÆÄĘ·Ö×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠø÷×éĄė×ÓÖŠÄÜŌŚČÜŅŗÖŠ“óĮæ¹²“ę£¬ĒŅČÜŅŗ³Ź¼īŠŌĶøĆ÷µÄŹĒ
AӢNa+ӢOH-ӢH2PO4-ӢNO3- BӢAlO2-ӢK+ӢCO32-ӢNa+
CӢAl3+ӢCl-ӢAlO2-ӢNa+ DӢFe2+ӢK+ӢH+ӢNO3-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
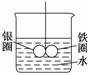
ČēĶ¼ĖłŹ¾µÄ×°ÖĆ£¬ŌŚĢśČ¦ŗĶŅųȦµÄŗø½Ó“¦£¬ÓĆŅ»øłĆŽĻß½«ĘäŠüµõŌŚŹ¢Ė®µÄÉÕ±ÖŠ£¬Ź¹Ö®Ę½ŗā”£Š”ŠÄµŲĻņÉÕ±ÖŠŃėµĪČėCuSO4ČÜŅŗ£¬Ę¬æĢŗóæɹŪ²ģµ½µÄĻÖĻóŹĒ
A£®ĢśČ¦ŗĶŅųȦ×óÓŅŅ”°Ś²»¶Ø B£®±£³ÖĘ½ŗāדæö
C£®ĢśČ¦ĻņĻĀĒ抱 D£®ŅųȦĻņĻĀĒ抱
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠÓŠ¹Ų»ÆѧÓĆÓļ±ķŹ¾ÕżČ·µÄŹĒ 
A£®ÖŹ×ÓŹżĪŖ53”¢ÖŠ×ÓŹżĪŖ78µÄµāŌ×Ó£ŗ131 53I B£®S2£µÄ½į¹¹Ź¾ŅāĶ¼£ŗ
C£®N2µÄµē×ÓŹ½£ŗ 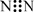 D£®NH4IµÄµē×ÓŹ½£ŗ
D£®NH4IµÄµē×ÓŹ½£ŗ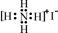
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠÓŠ¹ŲŹµŃéµÄ²Ł×÷ÓėĻÖĻóĆčŹö¼°Ļą¹Ų½įĀŪÕżČ·µÄŹĒ
A£®Č”ÉŁĮæČÜŅŗ£¬¼Ó¼øµĪKSCNČÜŅŗ£¬ČōÓŠŃŖŗģÉ«³Įµķ²śÉśŌņČÜŅŗÖŠŗ¬ÓŠFe3+
B£®Na2SO4”¤10H2OŹ§Ė®Ź±ĪüČČ£¬½į¾§Ź±·ÅČČ£¬Ņņ¶ųøĆ¾§ĢåæÉ×÷ĪŖ“¢ČČ²ÄĮĻŹµĻÖ»ÆѧÄÜÓėČČÄܵÄĻą»„×Ŗ»»
C£®Č”5mL0.1mol”¤L-1KIČÜŅŗ£¬µĪ¼Ó0.1mol”¤L-1FeCl3ČÜŅŗ5-6µĪ£¬¼ĢŠų¼ÓČė2mLCCl4£¬³ä·ÖÕńµ“ŗó¾²ÖĆ£¬Č”ÉĻ²ćČÜŅŗ¼ÓKSCNČÜŅŗ£¬ĪŽĆ÷ĻŌĻÖĻó
D£®Č”Ņ»Š”æ齚ŹōÄĘ£¬ÓĆĀĖÖ½ĪüøɱķĆęµÄĆŗÓĶ£¬·ÅČėÉÕ±ÖŠ£¬ŌŁ¼ÓŅ»¶ØĮæµÄĖ®£¬¹Ū²ģĻÖĻó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
25 ”ꏱ£¬ŌŚµČĢå»żµÄ¢ŁpH£½0µÄH2SO4ČÜŅŗ
¢Ś0.05 mol·L£1µÄBa(OH)2ČÜŅŗ””¢ŪpH£½10µÄNa2SČÜŅŗ””¢ÜpH£½5µÄNH4NO3ČÜŅŗÖŠ£¬·¢ÉśµēĄėµÄĖ®µÄĪļÖŹµÄĮæÖ®±ČŹĒ (””””)
A£®1”Ć10”Ć1010”Ć109 B£®1”Ć5”Ć5”Į109”Ć5”Į108
C£®1”Ć20”Ć1010”Ć109 D£®1”Ć10”Ć104”Ć109
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijæĘѧ¼ŅĄūÓƶžŃõ»Æīę£ØCeO2£©ŌŚĢ«ŃōÄÜ×÷ÓĆĻĀ½«H2O”¢CO2×Ŗ±ä³ÉH2”¢CO”£Ęä¹ż³ĢČēĻĀ£ŗ
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ

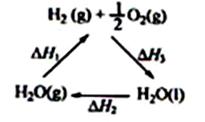
A£®øĆ¹ż³ĢÖŠCeO2ƻӊĻūŗÄ
B£®øĆ¹ż³ĢŹµĻÖĮĖĢ«ŃōÄÜĻņ»ÆѧÄܵÄ×Ŗ»Æ
C£®ÓŅĶ¼ÖŠ”÷H1=”÷H2+”÷H3
D£®H2(g)+ 1/2 O2(g) = H2O(g)µÄ·“Ó¦ČČŠ”ÓŚ”÷H3
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com