
| A、在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,说明硫酸具有还原性 | B、向SO2 水溶液中滴加盐酸酸化的BaCl2 溶液,有白色沉淀生成,说明BaSO4 难溶于盐酸 | C、在淀粉溶液中加入适量稀硫酸微热,再加少量新制氢氧化铜浊液加热,无红色沉淀,说明淀粉未水解 | D、向2.0mL浓度均为0.1mol?L-1 的KCl、KI混合溶液中滴加1~2滴0.01mol?L-1 AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大 |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、0.1mol氧气与足量的钠反应得电子数一定为0.4NA | B、0.1mol Na2CO3固体中共价键数为0.4NA | C、0.1mol?L-1 FeCl3溶液制成胶体,含有Fe(OH)3胶粒数一定小于O.1NAa | D、0.1mol甲基中含有电子数为0.7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
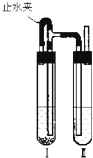 用下面两种方法可以制得白色的Fe(OH)2沉淀:
用下面两种方法可以制得白色的Fe(OH)2沉淀:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HIO3 | B、HIO2 | C、HIO | D、ICl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂粉精的主要成分为次氯酸钙 | B、实验室可用浓硫酸干燥氨气 | C、实验室可用NaOH溶液处理NO2、HCl废气 | D、Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“雾霾”与“风雨雷电”一样属于一种自然现象 | B、塑化剂是一种应用很广的化工塑料软化剂,可大量添加到婴幼儿玩具中 | C、利用潮汐能发电能达到节能减排的目的 | D、PM2.5的产生与人类活动无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食醋可除去水垢,NH4Cl溶液可除去铁锈 | B、发展新能源汽车的主要目的是为了减少PM2.5的排放 | C、“低碳生活”倡导生活中减少能耗,从而降低CO2排放 | D、“雾霾天气、光化学烟雾”的形成都与汽车排放的不合格尾气有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com