
| A. | 粗盐过滤时,用玻璃棒搅拌加快过滤的速度 | |
| B. | 蒸发滤液时,待蒸发皿中滤液蒸干时停止加热 | |
| C. | 配制溶液时必须使用的仪器有托盘天平、酒精灯、量筒、烧杯、玻璃棒等 | |
| D. | 配制溶液需要经过计算、称量、溶解、装瓶贴标签等步骤 |
分析 A.过滤时不能搅拌,否则会将滤纸损耗造成滤液泄漏;
B.蒸发滤液时不能蒸干;
C.配制溶液不需要酒精灯;
D.根据配制溶液的一般步骤进行分析.
解答 解:A.进行过滤操作的时候,如果使用玻璃棒搅拌有可能刺破滤纸造成滤液泄漏,故A错误;
B.而在蒸发溶液时,当发现蒸发皿中有大量固体析出时就应停止加热,用蒸发皿的余温蒸干溶液,不能蒸干,故B错误;
C.而在配制溶液中一般不需要加热,不选用酒精灯,故C错误;
D.配制溶液需要经过计算、称取固体、量取液体、溶解配置、装瓶贴标签这几个主要步骤,故D正确;
故选D.
点评 本题考查了粗盐的提纯方法及判断,题目难度不大,明确化学实验基本操作方法为解答关键,注意掌握粗盐的正确提纯方法,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 向稀 HNO3 中滴加 Na2SO3 溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+2H+=I2+2H2O | |
| C. | 向 Al2(SO4)3 溶液中加入过量 NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
 ,该化合物所含化学键类型是:离子键(填“共价键”或“离子键”).
,该化合物所含化学键类型是:离子键(填“共价键”或“离子键”).| 实验步骤 | 实验现象与结论 |
| . |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
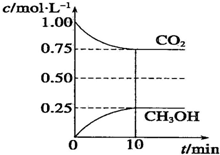 在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-akJ.mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-akJ.mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3):n (O2)=4:5 | |
| B. | 反应达到平衡后,对体系一直进行加压,平衡总是向逆向移动 | |
| C. | 反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动 | |
| D. | 当v正(NH3):v正(NO)=1:1 时,说明该化学反应已经达到平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com