
| N2H4 | N2O4 | |
| 密度/g/cm3 | 1.004 | 1.44 |
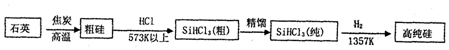
分析 (1)二氧化硅和焦炭反应制取粗硅SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,粗硅和氯化氢反应Si+3HCl$\frac{\underline{\;573K\;}}{\;}$SiHCl3+H2,生成三氯硅烷,氢气在高温下与三氯硅烷反应提纯粗硅,反应为SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,得到纯硅.①SiHCl3与氢气发生置换反应生成硅和氯化氢;②写出反应物和给出的生成物H2SiO3和HCl,用原子守恒法找出另一种生成物为H2,并配平;氢气遇氧气易爆炸;
(2)SiO32-与NH4+发生双水解反应,生成氨气和硅酸沉淀;
(3)依据热化学方程式和盖斯定律计算,③×2-②×2-①得目标方程式,据此计算△H4,同一条件下,体积比等于物质的量之比,根据2N2 H4 (1)+N2O4 (1)=3N2 (g)+4H2O(g)以及N2H4、N2O4的密度计算;
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离方程式为N2H4+H2O?N2H5++OH-,平衡常数Kb=$\frac{C({N}_{2}{{H}_{5}}^{+})C(O{H}^{-})}{C({N}_{2}{H}_{4})}$=$\frac{C({N}_{2}{{H}_{5}}^{+})C(O{H}^{-})}{C({N}_{2}{H}_{4})}$×$\frac{C({H}^{+})}{C({H}^{+})}$=K×Kw,由于是二元碱,因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2;
(5)联胺被银离子氧化,银离子被还原生成单质银,联胺被氧化失电子N2H4~N2-4e-,O2~4e-,依据守恒计算判断,依据锅炉的质地以及反应产物性质解答.
解答 解;(1)①在1357K的条件下,氢气和纯SiHCl3反应生成高纯硅和氯化氢:SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,
故答案为:SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑,H2还原SiHCl3过程中若混入O2,高温下,可能引起爆炸,
故答案为:SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑;高温下,H2遇O2发生爆炸;
(2)SiO32-与NH4+发生双水解反应生成白色絮状沉淀,又刺激性气味的气体生成,方程式为:SiO32-+2NH4++2H2O═2NH3•H2O+H2SiO3↓,
故答案为:生成白色絮状沉淀,又刺激性气味的气体生成,SiO32-与NH4+发生双水解反应,生成氨气和硅酸沉淀;
(3)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
依据热化学方程式和盖斯定律计算③×2-②×2-①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=2△H3-2△H2-△H1,根据反应④可知,折算在标准状况下的数据,燃爆后气体的体积与燃爆前的体积之比为:$\frac{V后}{V前}$=$\frac{7×22.4×1000}{\frac{2×32}{1.004}+\frac{92}{1.44}}$=1228.6,
故答案为:2△H3-2△H2-△H1;1228.6;
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离方程式为N2H4+H2O?N2H5++OH-,平衡常数Kb=$\frac{C({N}_{2}{{H}_{5}}^{+})C(O{H}^{-})}{C({N}_{2}{H}_{4})}$=$\frac{C({N}_{2}{{H}_{5}}^{+})C(O{H}^{-})}{C({N}_{2}{H}_{4})}$,×$\frac{C({H}^{+})}{C({H}^{+})}$=K×Kw=8.7×107×1.0×10-14=8.7×10-7,第二步电离方程式为N2H5++H2O?N2H62++OH-,因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2,
故答案为:8.7×10-7;N2H6(HSO4)2;
(5)联胺被银离子氧化,银离子被还原生成单质银,-2价的N元素被氧化为N2,反应方程式为:N2H4+4AgBr=4Ag↓+N2↑+4HBr,因此反应出现现象为:固体逐渐变黑,并有气泡产生,由于肼的氧化产物是氮气,不会对锅炉造成腐蚀,而亚硫酸钠被氧化产物为硫酸钠,易生成硫酸盐沉淀影响锅炉的安全使用,联胺被氧化失电子N2H4→N2失去4e-,O2→O2-得到4e-,联胺和氧气摩尔质量都是32g/mol,则等质量联胺和氧气物质的量相同,理论上1kg的联氨可除去水中溶解的O21kg,与使用Na2SO3处理水中溶解的O2相比,联氨的优点是用量少,不产生其他杂质(反应产物为N2和H2O),而Na2SO3产生Na2SO4,
故答案为:固体逐渐变黑,并有气泡产生;1;N2H4的用量少,不产生其他杂质(反应产物为N2和H2O),而Na2SO3产生Na2SO4.
点评 本题考查了硅及其化合物知识、氮及其化合物性质、物质结构、热化学方程式和盖斯定律计算应用、平衡常数的计算方法,熟悉相关物质的性质是解答关键,注意粗硅提纯、硅、二氧化硅用途,注意盖斯定律的熟练应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 甲同学说:该条件下NaHCO3的溶解度较小 | |
| B. | 乙同学说:NaHCO3不是纯碱 | |
| C. | 丙同学説:析出NaHCO3固体后的溶液中只含氯化铵和氯化钠 | |
| D. | 丁同学说:从该反应可以获得氮肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱式滴定管用蒸馏水洗净后,直接注入标准浓度的NaOH溶液 | |
| B. | 碱式滴定管尖端有气泡,滴定后气泡消失 | |
| C. | 记录消耗的碱液,滴定前平视,滴定后俯视凹液面 | |
| D. | 锥形瓶用蒸馏水洗净后,直接装入未知浓度的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
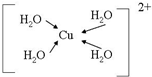 (配位键用→标出).
(配位键用→标出).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 任意条件下,16g O3所含的原子数为NA | |
| C. | 由CH4和C2H6组成的混合物中共有NA个分子,其中的氢原子数为5NA | |
| D. | 46 g二氧化氮和46 g四氧化二氮含有的原子数均是6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com