
| A. | 铪-185的原子核内有72个电子 | B. | 其中子数比电子数多41 | ||
| C. | 是铪-180的一种新的同素异形体 | D. | 铪-185的原子核内有185个质子 |
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:填空题
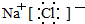 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
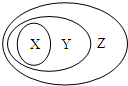 用图表示的一些物质或概念间的从属关系中错误的是( )
用图表示的一些物质或概念间的从属关系中错误的是( )| X | Y | Z | |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 钢铁 | 合金 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNa2SO4溶液中含有的Na+数是0.2×6.02×1023 | |
| B. | 1molMg变成Mg2+时失去的电子数是6.02×1023 | |
| C. | 常温常压下,16gO2中含有的原子数是6.02×1023 | |
| D. | NO的摩尔质量与6.02×1023个NO分子的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式: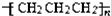 | B. | 乙醇的结构简式:CH3CH2OH | ||
| C. | 四氯化碳的电子式: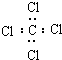 | D. | -CH3(甲基)的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电极 | 电极材料 | 电极反应式 |
| 负极 | ||
| 正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
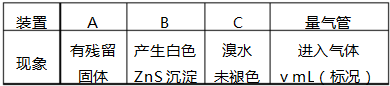

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
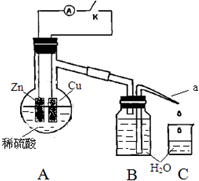 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com