
| A. | 亚硫酸在溶液中主要的电离方程式:H2SO3?H ++HSO3- | |
| B. | 用铁棒作阳极电解饱和氯化钠溶液的反应:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 热的纯碱溶液可以清洗油污的原因:CO32-+H2O?HCO3-+OH- | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe一2e-═Fe2+. |
分析 A.亚硫酸为多元弱酸分步电离,以第一步为主;
B.铁做阳极,为活性电极,电极本身失去电子发生氧化反应;
C.碳酸根离子为多元弱酸根离子,分步水解,以第一步为主;
D.钢铁发生电化学腐蚀,铁做负极发生氧化反应.
解答 解:A.亚硫酸在溶液中主要的电离方程式:H2SO3?H ++HSO3-,故A正确;
B.用铁棒作阳极电解饱和氯化钠溶液的反应,离子方程式:Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Fe(OH)2↓,故B错误;
C.热的纯碱溶液可以清洗油污,离子方程式:CO32-+H2O?HCO3-+OH-,故C正确;
D.钢铁发生电化学腐蚀,铁做负极发生氧化反应,电极反应式为:Fe一2e-═Fe2+,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,涉及盐类的水解、弱电解质的电离、钢铁的吸氧腐蚀、电解池,掌握基础是解题关键,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
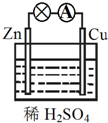
| A. | Zn为正极,Cu为负极 | B. | 该装置将化学能转变为电能 | ||
| C. | 正极反应式为Cu-2e-═Cu2+ | D. | 电子由铜片通过导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应为Zn-2e-═Zn2+ | |
| B. | 电池总反应为Zn+Cu2+═Zn2++Cu | |
| C. | 取出盐桥,电流表指针仍然偏转 | |
| D. | 盐桥(填充KCl饱和溶液侵泡的琼脂)中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
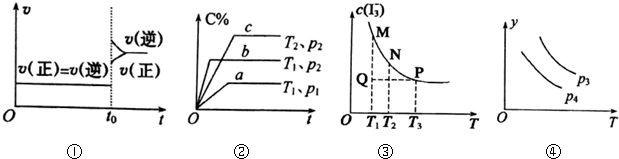
| A. | 图①对于达到平衡状态的N2(g)+3H2(g)?2NH3(g),在t0时刻充入了一定量的NH3,平衡逆向移动 | |
| B. | 图②p2<p1,T1<T2 | |
| C. | 图③是反应:I2(aq)+I-(aq)?I3-(aq)的平衡体系中,I3-的物质的量浓度与温度(T)的关系图(曲线上的任何一点都代表平衡状态):Q点时,v正>v逆 | |
| D. | 图④对于反应2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Z的百分含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)CH3OH是一种可燃性的液体.
(1)CH3OH是一种可燃性的液体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
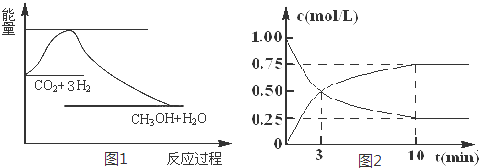
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L Cl2与H2O反应,转移的电子总数为0.1NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com