
| A. | Na>O | B. | Na+>O2- | C. | Mg>Na | D. | Mg2+>Na+ |
分析 微粒半径大小一般原则:电子层数不同,电子层数越多,半径越大;
电子层数相同的,质子数越多半径越小;据此解答.
解答 解:A、Na有3个电子层,O有2个电子层,电子层越多,半径越大,所以粒子半径Na>O,故A正确;
B、Na+、O2-有2个电子层,电子层相同,核电荷数越多,半径越小,所以离子半径:Na+<O2-,故B错误;
C、Mg、Na有3个电子层,电子层相同,核电荷数越多,半径越小,所以粒子半径Na>Mg,故C错误;
D、Mg2+、Na+有2个电子层,电子层相同,核电荷数越多,半径越小,所以离子半径:Mg2+<Na+,故D错误.
故选A.
点评 本题考查微粒半径比较,题目难度中等,为元素周期律中常考查知识点,学习中注意积累相关比较方法,注重元素周期律递变规律的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2 | B. | NaOH | C. | BaCl2 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3 | B. | NaOH | C. | H2SO4 | D. | CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吗啡 | B. | 可卡因 | C. | 甘油 | D. | 海洛因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2 | B. | △H1<△H2 | C. | △H1=△H2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
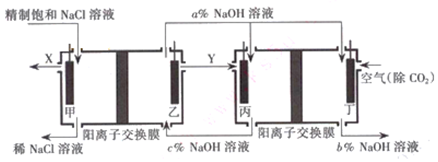
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色 | |
| B. | 甲烷与氯气在光照条件下的反应 | |
| C. | 苯和液溴在铁作催化剂的条件下反应 | |
| D. | 乙醇与氧气在铜作催化剂及加热条件下的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com