
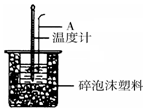
 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.分析 (1)中和热测定实验成败的关键是保温工作;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失;
(3)根据装置图分析;中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,温度差偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析;
(6)中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式.
解答 解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是保温、隔热、减少实验过程中的热量损失;
故答案为:保温、隔热、减少实验过程中的热量损失;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)由装置图可知,仪器A的名称是环形玻璃搅拌棒;中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,温度差偏小,热量偏小,但测得的中和热偏大,即△H>-57.3KJ/mol;
故答案为:环形玻璃搅拌棒;>;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高;中和热是指在稀溶液中,酸跟碱发生中和反应生成1molH2O时的反应热,与实验过程中试剂的用量无关,所以所求中和热相等;
故答案为:不相等;相等;中和热是指在稀溶液中,酸跟碱发生中和反应生成1molH2O时的反应热,与实验过程中试剂的用量无关;
(5)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小;
(6)稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,稀硝酸和稀氢氧化钠溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H=-57.3KJ/mol;
故答案为:HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H=-57.3KJ/mol.
点评 本题考查了中和热的测定、热化学方程式的书写、反应热的计算等,题目难度中等,注意对中和热概念的理解以及中和热测定的实验操作方法,侧重于考查学生的分析能力、计算能力和实验探究能力.


科目:高中化学 来源: 题型:多选题
| A. | 混合气体的密度不随时间变化而变化 | |
| B. | 3v正(B)=v逆(D) | |
| C. | D的物质的量分数在混合气体中保持不变 | |
| D. | B、C、D的分子个数之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,相同体积的SO2和SO3,质量比为4:5 | |
| B. | 相同状况下,质量相同的O2和O3,密度之比为3:2 | |
| C. | 相同质量的金刚石和石墨含有相同的C原子数和共价键数 | |
| D. | 标准状况下,相同体积的C2H2和C2H4,密度比为13:14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- | |
| B. | 加入BaCl2溶液产生了白色沉淀,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| C. | 加入盐酸酸化的氯化钡溶液,产生白色沉淀,则溶液中一定有SO42- | |
| D. | 加入盐酸,溶液无明显现象,再加BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (NH3)=0.3 mol•L-1•min-1 | B. | v (H2)=0.3mol•L-1•min-1 | ||
| C. | v(N2)=0.2 mol•L-1•min-1 | D. | v (N2)=0.05mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com