
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且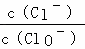 的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
|
| A. | 若某温度下,反应后 |
|
| B. | 参加反应的氯气的物质的量等于3a mol |
|
| C. | 改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol |
|
| D. | 改变温度,产物中KClO3的最大理论产量为a mol |
| 化学方程式的有关计算. | |
| 专题: | 计算题. |
| 分析: | A.令n(ClO﹣)=1mol,反应后=11,则n(Cl﹣)=11mol,根据电子转移守恒计算n(ClO3﹣),据此计算判断; B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH); C.氧化产物只有KClO3时,转移电子最多,氧化产物只有KClO时,转移电子最少,根据电子转移守恒及钾离子守恒计算; D.氧化产物只有KClO3时,其物质的量最大,结合C中计算判断. |
| 解答: | 解:A.令n(ClO﹣)=1mol,反应后 B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量= C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)= D.氧化产物只有KClO3时,其物质的量最大,由C中计算可知:n最大(KClO3)= 故选A. |
| 点评: | 本题考查氧化还原反应计算,难度中等,注意电子转移守恒及极限法的应用. |


科目:高中化学 来源: 题型:
实验室里需用480 mL 0.1 mol·L-1的硫酸铜溶液,现选用500 mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾,配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g胆矾,配成500 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,下列叙述正确的是 ( )
A.pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:
c(H+) + c(M+)=c(OH-) + c(A-)
B.将物质的量浓度均为0.1mol·L−1的Na2CO3溶液、NaHCO3溶液等体积混合所得溶液中:2c(OH−)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32−)
C.等浓度、等体积的Na2CO3和NaHCO3混合: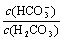 <
<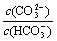
D.将足量AgCl分别放入:①5m水②10mL0.2mol/LMgC12③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )
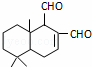
|
| A. | Br2的CCl4溶液 | B. | Ag(NH3)2OH溶液 | C. | HBr | D. | H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以石化产品乙烯、丙烯为原料合成厌氧胶的流程如图:

关于该过程的相关叙述正确的是( )
|
| A. | 反应④的反应类型是缩聚反应 |
|
| B. | 物质A是卤代烃 |
|
| C. | 物质B催化氧化后可以得到乙醛 |
|
| D. | 1 mol物质D最多可以消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
不饱和酯类化合物在药物、涂料等领域应用广泛.下列反应是一种由烯烃制备不饱和酯的新方法:

(1)化合物I的分子式为 ,1mol化合物I能与 mol H2恰好完全反应生成饱和烃类化合物.
(2)化合物Ⅰ可由芳香族化合物Ⅱ或Ⅲ分别通过消去反应获得,但只有Ⅱ能与Na反应产生H2,Ⅱ的结构简式为 、 ;由Ⅲ生成Ⅰ的反应条件为 .
(3)聚合物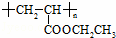 可用于制备涂料,其单体结构简式为 .若仅以乙烯为唯一有机物原料合成该聚合物,写出其中涉及的化学反应方程式
可用于制备涂料,其单体结构简式为 .若仅以乙烯为唯一有机物原料合成该聚合物,写出其中涉及的化学反应方程式
.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于摩尔的说法中,正确的是( )
A.摩尔是表示物质质量的单位
B.摩尔是七个基本物理量之一
C.摩尔是表示物质的数量的单位
D.摩尔是物质的量的单位
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
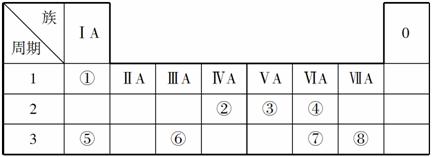
(1)请画出元素⑥的离子结构示意图:________。
(2)元素⑦中质子数和中子数相等的同位素符号是____________。
(3)④⑤⑦的简单离子半径由大到小的顺序为____________。
(4)②的最高价氧化物对应水化物的电离方程式为__________________。
(5)④⑤两种元素的原子按1:1组成的常见化合物的电子式为________。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为____________________。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16 g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量,写出A与B反应的热化学方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com