
下列反应既是氧化还原反应,又是吸热反应的是( )
A. 铝片与稀H2SO4反应 B. Ba(OH)2•8H2O与NH4Cl反应
C. 灼热的炭与CO2反应 D. 甲烷在O2中的燃烧反应
考点: 氧化还原反应;吸热反应和放热反应.
专题: 氧化还原反应专题;化学反应中的能量变化.
分析: 有元素化合价变化的反应为氧化还原反应;常见的吸热反应有Ba(OH)2•8H2O与NH4Cl反应、C参加的氧化还原反应、大多数的分解反应等,以此来解答.
解答: 解:A.铝片与稀H2SO4反应,有化合价的变化属于氧化还原反应,但属于放热反应,故A不选;
B.Ba(OH)2•8H2O与NH4Cl反应为吸热反应,但不属于氧化还原反应,故B不选;
C.灼热的炭与CO2反应,有化合价的变化属于氧化还原反应,且属于吸热反应,故C选;
D.甲烷在O2中的燃烧反应,有化合价的变化属于氧化还原反应,但属于放热反应,故D不选;
故选:C.
点评: 本题考查氧化还原反应及吸热反应,明确元素的化合价变化及常见的吸热反应即可解答,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
鲜榨苹果汁是人们喜爱的饮料.由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色Fe3+.这个变色的过程中的Fe2+被 (填“氧化”或“还原”).若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生.这说明维生素C具有: .
A、氧化性 B、还原性 C、酸性 D、碱性.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知酸性大小:羧酸>碳酸>酚.下列含溴化合物中的溴原子,在适当条件下都能被羟基(﹣OH)取代(均可称为水解反应),所得产物能跟NaHCO3溶液反应的是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 乙酸与碳酸钠溶液反应:2H++CO32﹣═CO2↑+H2O |
|
| B. | 醋酸溶液与新制氢氧化铜反应:Cu(OH)2+2H+═Cu2++2H2O |
|
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+CO2+H2O |
|
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
药用有机物A为一种无色液体.从A出发可发生如下一系列反应
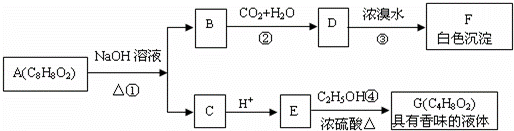
请回答:
(1)写出化合物F结构简式: .
(2)写出反应①的化学方程式: .
(3)写出反应④的化学方程式: .
(4)有机物A的同分异构体甚多,其中属于羧酸类的化合物,且含有苯环结构的异构体有 种
(5)E的一种同分异构体H,已知H可以和金属钠反应放出氢气,且在一定条件下可发生银镜反应.试写出H的结构简式: .
E的另一种同分异构体R在一定条件下也可以发生银镜反应,但不能和金属钠反应放出氢气.试写出R的结构简式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率和限度的说法中,不正确的是( )
A. 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用碳酸钙和盐酸反应制取CO2,用粉末状碳酸钙比块状反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子:aA2+、bB+、cC3﹣、dD﹣都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径 A>B>D>C B. 原子序数 d>c>b>a
C. 离子半径 C>D>B>A D. 单质的还原性 A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速度最快的是( )
|
| A. | V(NH3)=0.1mol/(L•min) | B. | V(N2)=0.1mol/(L•min) |
|
| C. | V(N2)=0.2mol/(L•min) | D. | V(H2)=0.3mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com