
| A、加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- |
| B、c(Fe3+)=0.1mol/L的溶液中:NH4+、Cl-、AlO2-、SO42- |
| C、水电离出的c(H+)=1×10-13mol/L的溶液中:Mg2+、K+、NO3-、Cl- |
| D、含有SCN-离子的溶液中:Ca2+、Fe2+、NO3-、Cl- |


科目:高中化学 来源: 题型:
| A、绿色、红褐色的絮状物质就是从脚底排出的体内毒素 |
| B、绿色、红褐色的絮状物质是氢氧化亚铁和氢氧化铁 |
| C、此电动脚盆仪器一定是用惰性电极制成的 |
| D、往注满水的盆中加一些精盐的目的是降低溶液的导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2、Cl2都具有很强的氧化性,在反应中只能做氧化剂 |
| B、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C、14C可用于文物的年代鉴定,14C与12C中所含质子数不同 |
| D、有单质参加或生成的反应一定属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br- |
| B、常温下PH=1的溶液中:Fe2+、Mg2+、NO3-、Cl- |
| C、含有大量Fe3+的溶液中:SCN-、I-、K+、Br- |
| D、能使石蕊试液显红色的溶液中:K+、SO42-、S2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、K+、Cl-、MnO4- |
| B、K+、Na+、NO3-、Cl- |
| C、Zn2+、Al3+、SO42-、Cl- |
| D、Ba2+、NH4+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇的结构简式为:C2H6O |
B、硫离子的结构示意图为: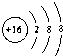 |
| C、NaHCO3电离:NaHCO3=Na++H++CO32- |
D、氮分子的结构式为: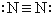 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、7d | B、5d |
| C、2.5d | D、2d |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com