
 在一定温度下,难溶化合物饱和溶液的离子浓度的乘积为一常数,这个常数用
在一定温度下,难溶化合物饱和溶液的离子浓度的乘积为一常数,这个常数用 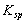 表示。已知:
表示。已知: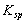 (AgCl) = = 1.8×10-10;
(AgCl) = = 1.8×10-10;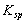 (Ag2CrO4) = 2 = 1.9×10-12
(Ag2CrO4) = 2 = 1.9×10-12
现有0.001 mol·L-1 AgNO3溶液滴定0.001 mol·L-1 KCl和0.001 mol·L-1 的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42- 哪种先沉淀?
(2)当CrO42- 以 Ag2CrO4 形式沉淀时,溶液中的Cl- 离子浓度是多少? CrO42- 与Cl- 能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5 mol·L-1 时,则认为可以达到有效分离)
(1)题目中给出的溶解标准,可推知各离子的起始浓度:
c(Tl+) = 0.2 mol·L-1,c(S2-) = 0.1 mol·L-1 。
在1 mol·L-1 的一元强酸中,c(H+) = 1 mol·L-1;c(S2-) ≈10 21 mol·L-1;
c2(Tl+)c(S2-) = 4×10-23<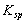 (Tl2S)
(Tl2S)
(2)Cu2+不与Cl- 形成稳定的配合物,c(Cu2+)c(S2-) =10-22>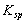 (CuS),所以 CuS不溶于1 mol·L-1盐酸中。
(CuS),所以 CuS不溶于1 mol·L-1盐酸中。
10、(1)AgCl饱和所需Ag+浓度1=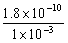 = 1.8×10-7 mol·L-1;Ag2CrO4饱和所需Ag+ 浓度2=
= 1.8×10-7 mol·L-1;Ag2CrO4饱和所需Ag+ 浓度2=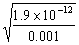 = 4.36×10-5 mol·L-1;1<2,Cl-先沉淀。
= 4.36×10-5 mol·L-1;1<2,Cl-先沉淀。
(2)Ag2CrO4开始沉淀时=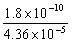 = 4.13×10-6<10-5,所以能有效地分离。
= 4.13×10-6<10-5,所以能有效地分离。


科目:高中化学 来源: 题型:
将镁和铝的混合物5.1 g投入500 mL 2 mol/L稀盐酸中,生成氢气0.5 g;再加入4 mol/L的NaOH溶液,当生成沉淀的质量最多时,加入NaOH溶液的体积与沉淀质量的最大值均正确的是
A.250 mL、13.6 g B.500 mL、5.6 g C.125 mL、10.2 g D.1000 mL、7.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快 反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g·mL-1),在标准状况下放出气体的体积和时间的关系如下图所示,回答下列问题:
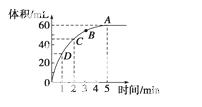
(1)A、B、C、D四点化学反应速率快慢的顺序为
________________________________________________________________________。
(2)解释反应速率变化的原因
________________________________________________________________________。
(3)计算过氧化氢的初始 物质的量浓度
物质的量浓度
________________________________________________________________________。
(4)求反应进行到2分钟时过氧化氢的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
将食盐晶体与浓磷酸共热可得磷酸二氢钠与氯化氢气体;在磷酸二氢钠溶液中通入氯化氢气体又可得磷酸与氯化钠。上述两反应是否矛盾?若不矛盾,试以平衡移动原理解释。
查看答案和解析>>
科目:高中化学 来源: 题型:
能够使反应Cu+2H2O====Cu(OH)2+H2↑发生的是( )
A.用铜片作阴、阳极,电解氯化铜溶液
B.用铜片作阴、阳极,电解硫酸钾溶液
C.铜锌合金在潮湿空气中发生电化学腐蚀
D.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们溶于水,在水中电离出的阳离子有K+、Ag+,阴离子 有NO3-、OH-(电解质电离的离子有重复)。
有NO3-、OH-(电解质电离的离子有重复)。
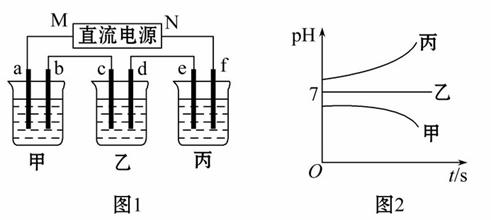
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极。接通电源,经过一段时间后,测得甲中b电极质量增加了43.2 g。常温下各烧杯中溶液pH与电解时间t关系如图2所示。请回答下列问题:
(1)写出三种强电解质的化学式:A__________;B_________;C_________。
(2)写出乙烧杯c电极发生的电极反应为_________,甲烧杯中的总反应的化学方程式为____________________________________。
(3)计算丙烧杯e电极上生成的气体在标准状况下的体积为_________,甲烧杯中溶液体积为100 mL,pH=_________。
(4)要使甲烧杯中的A溶液恢复到电解前的状态,需要加入的物质是_________,其质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
类推思维是化学解题中常用的一种思维方法.下列有关离子方程式的类推正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+═Cu+2Na+ |
| B | 稀硫酸加入Ba(OH)2溶液至中性 2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O | NaHSO4溶液加入Ba(OH)2溶液至中性 H++SO42﹣+Ba2++OH﹣═BaSO4↓+H2O |
| C | 向氯化铝溶液中加入足量NaOH溶液 Al3++4OH﹣═AlO2﹣+2H2O | 向氯化铝溶液中加入足量氨水 Al3++4NH3•H2O═AlO2﹣+2H2O+4NH4+ |
| D | 向Ca(OH)2溶液中通入过量CO2 CO2+OH﹣═HCO3﹣ | 向Ca(OH)2溶液中通入过量SO2 SO2+OH﹣═HSO3﹣ |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
( )
|
| A. | ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓ |
|
| B. | 原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
|
| C. | 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
|
| D. | d点溶液中含有的溶质只有NaAlO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com