
���� ��1��Ԫ�ػ��ϼ����߱�������Ԫ�ػ��ϼ۽��ͱ���ԭ���õ���ԭ�������OԪ�صĻ��ϼ۱仯����ת�Ƶ�������
��2���������̲�����ˮ���ù��˵ķ������룻
��3���ڼ��������£�����������Ũ���ᷴӦ�����Ȼ��̡�������ˮ��
��4�����ݷ���ʽ�������㣻
��5������غͶ���������ȡ����ʱ�������̲��μӷ�Ӧ��MnO2��Ũ���ᷴӦ��������ʱ����������MnԪ�صĻ��ϼ۽��ͣ�
��� �⣺��1��2KClO3$\frac{\underline{MnO_2}}{��}$2KCl+3O2����Ӧ�У�OԪ�ػ��ϼ����߱�������ClԪ�ػ��ϼ۽��ͱ���ԭ���õ���KClΪ��ԭ���OԪ�صĻ��ϼ۴�-2�����ߵ�0�ۣ�������1molO2ʱת�Ƶ��ӵ���Ŀ��4NA��
�ʴ�Ϊ����Ԫ�أ�KCl��4NA��
��2������غͶ������̻������ȣ�����طֽ������Ȼ��أ���Ӧ���������Ϊ�������̺��Ȼ��أ���ˮ�ܽ⣬�������̲�����ˮ��Ȼ����ˡ�ϴ�ӡ�����õ��������̹��壻
�ʴ�Ϊ������Ӧ��Ļ��������ձ����ܽ⡢���ˣ���������ϴ�ӡ����
��3���ڼ��������£�����������Ũ���ᷴӦ�����Ȼ��̡�������ˮ���䷴Ӧ�����ӷ���ʽΪ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
�ʴ�Ϊ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
��4��2KClO3$\frac{\underline{MnO_2}}{��}$2KCl+3O2���ķ�Ӧ������3mol����ת��12mol���ӣ�MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$Cl2��+MnCl2+2H2O��Ӧ�У�����1mol����ת��2mol���ӣ���ת��1mol����ʱ����6mol����������ת�Ƶĵ��ӵ����ʵ�����ͬ�������ɵ�O2��Cl2����ͬ״���µ������Ϊ3��6=1��2��
�ʴ�Ϊ��1��2��
��5������غͶ���������ȡ����ʱ�������̲��μӷ�Ӧ������������������MnO2��Ũ���ᷴӦ��������ʱ����������MnԪ�صĻ��ϼ۽��ͣ�������������������
�ʴ�Ϊ����������������
���� ���⿼����������ԭ��Ӧ�����ʷ���Ļ������������ӷ���ʽ����д������ת�����ļ���ȣ���Ŀ�Ѷ��еȣ������ڻ���֪ʶ���ۺ�Ӧ�õĿ��飬ע�����������ԭ��Ӧ�л��ϼ۵ı仯�ķ����жϣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ������������������c��H+����c ��OH-��=Kw | |
| B�� | T��25 | |
| C�� | b���c��pH��Ϊ6����Һ������ | |
| D�� | ֻ�������µķ�ʽ������a����d�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������Ȼ�����Һ��Ѫ��ɫ | B�� | ������Һ������ر���ɫ | ||
| C�� | ֲ��������ˮ���ɫ | D�� | ����ͭ���ȵ��Ҵ����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ����� | ����Һ���/mL | ������Һ���/mL | ||
| �ζ�ǰ�̶� | �ζ���̶� | ƽ��ֵ | ||
| 1 | 25.00 | 0.00 | 14.97 | �� |
| 2 | 25.00 | 0.10 | 15.13 | |
| 3 | 25.00 | 0.22 | 14.93 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

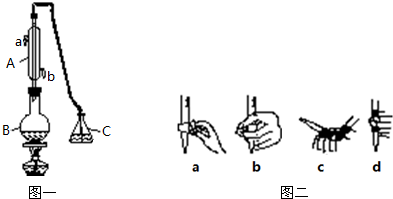
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮ��Һ���ʼ��ԣ�̼��������������ʷ������ڼ� | |
| B�� | ���߾���ϡ���ᷴӦ����CO2����̼�����ƺ����ᷴӦ������ | |
| C�� | �þƾ��Ƽ���ʱ���߾��ɷ����ֽⷴӦ����̼�����Ƹ��ֽ� | |
| D�� | ���߾��ɺͳ���ʯ��ˮ������Ӧ����̼�����Ʒ�Ӧʱ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�14.2�� Na2SO4���е�Na+������Ϊ0.2NA | |
| B�� | ��״���£�22.4LH2O���еķ�����Ϊ NA | |
| C�� | ͨ��״���£�NA��N2����ռ�е����Ϊ22.4L | |
| D�� | ���ʵ���Ũ��Ϊ0.5 mol/L��MgCl2��Һ�У�����Cl- ����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
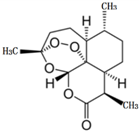 2015��10�£��й�Ůҩѧ���������������Ϳ�űҩ--�����غ�˫�������صĹ��ף���������λ��ѧ�ҹ���2015���ŵ��������ѧ��ҽѧ���������й�����ҽѧ������Ϊֹ��õ����缶����������صļ���ʽ��ѧ�ṹ��ͼ��ʾ������˵������ȷ���ǣ�������
2015��10�£��й�Ůҩѧ���������������Ϳ�űҩ--�����غ�˫�������صĹ��ף���������λ��ѧ�ҹ���2015���ŵ��������ѧ��ҽѧ���������й�����ҽѧ������Ϊֹ��õ����缶����������صļ���ʽ��ѧ�ṹ��ͼ��ʾ������˵������ȷ���ǣ�������| A�� | ���������ڷ��㻯�������H2�����ӳɷ�Ӧ | |
| B�� | ��������������������Һ������Ӧ | |
| C�� | �����صĻ�ѧʽΪC15H22O5 | |
| D�� | �����صĺ˴Ź�����ͼ����12���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ٵ����������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ��
���ٵ����������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ��| t��s�� | 0 | 500 | 1000 | 1500 |
| n��NO2����mol�� | 20 | 13.96 | 10.08 | 10.08 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com