
| A. | 标准状况下,22.4 L乙醇中分子数为NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| C. | 1.8g的NH4+中含有的电子数为1.1NA | |
| D. | 在1 L 2 mol/L的盐酸中,存在2NA个氯化氢分子 |
分析 A.标准状况下,乙醇的状态不是气体;
B.稀有气体为单原子分子,含有NA个氦原子的氦气的物质的量为1mol;
C.铵根离子含有10个电子,根据n=$\frac{m}{M}$计算出铵根离子的物质的量,然后设计成含有电子的物质的量及数目;
D.氯化氢为强电解质,溶液中不存在氯化氢分子.
解答 解:A.标况下乙醇不是气体,不能使用标况下的气体摩尔体积计算,故A错误;
B.含有NA个氦原子的氦气的物质的量为1mol,在标准状况下1mol氦气的体积约为22.4L,故B正确;
C.1.8g的NH4+的物质的量为:$\frac{1.8g}{18g/mol}$=0.1mol,0.1mol铵根离子中含有1mol电子,含有的电子数为NA,故C错误;
D.HCl为强电解质,在溶液中完全电离,则溶液中不存在HCl分子,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:填空题
| 用途或反应 | 硫酸或硝酸表现的性质 |
| (1)用稀硫酸和锌粒制氢气 | |
| (2)用浓硫酸和食盐固体制氯化氢 | |
| (3)用稀硝酸洗涤试管壁上附着的银 | |
| (4)浓硫酸、浓硝酸可用钢瓶贮运 | |
| (5)久置的浓硝酸显黄色 | |
| (6)打开浓硝酸瓶塞时,瓶口有白雾生成 | |
| (7)敞口的浓硫酸,放置一段时间后质量变大 | |
| (8)浓硫酸可使湿润的蓝色石蕊试纸先变红,后变黑 | |
| (9)浓硝酸可使湿润的蓝色石蕊试纸先变红,后褪色 | . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①④②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)不变,KW不变 | |
| C. | 增大水的体积,则水中 n(H+) 与n(OH-) 乘积变大 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 化合物 X全部由短周期元素组成,X加热分解,可得 A、B、C、D、E和H2O六种产物,其中 A、B、C 都是中学化学中常见的氧化物,气体 D是单质E所含元素的氢化物.
化合物 X全部由短周期元素组成,X加热分解,可得 A、B、C、D、E和H2O六种产物,其中 A、B、C 都是中学化学中常见的氧化物,气体 D是单质E所含元素的氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②④ | C. | ②③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
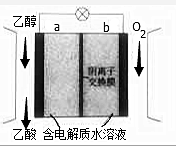 利用如图装置可实现用空气直接高效氧化乙醇制取乙酸.下列有关说法错误的是( )
利用如图装置可实现用空气直接高效氧化乙醇制取乙酸.下列有关说法错误的是( )| A. | a为电池负极 | |
| B. | 电流由b极沿导线流向a 极 | |
| C. | 电池总反应为CH3CH2OH+O2=CH3COOH+H2O | |
| D. | 每生成1mol乙酸,有4molOH-迁移到b极区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com