
【题目】依据叙述,写出下列反应的热化学方程式:
(1)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为______________________________________________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为
__________________________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
___________________________________________________________________。
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
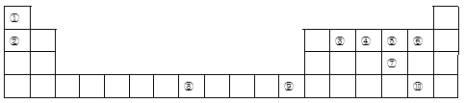
(1)比较①和②具有相同核外电子排布的简单离子半径大小关系为______________(填化学式);③、④、⑤三种元素的第一电离能由大到小的顺序为____________(填元素符号),写出原子序数和元素⑧相差2且元素⑧同族的元素基态原子的外围电子排布式____________。
(2)在元素③与①形成的原子个数比为1:1的四原子分子中,③原子的杂化方式为____________。其分子中δ键和π键数目之比为____________。
(3)元素④的某种氢化物甲分子中含有18个电子,甲为二元弱碱,在水中的电离方程式与氨相似。写出甲在水中的第一步电离的电离方程式____________。甲在微电子工业中,可作刻蚀剂H2O2的清除剂,二者发生反应的产物不污染环境,其化学方程式为____________。
(4)元素⑥和⑤形成分子乙的结构与元素①和⑤形成的最简单分子丙相似,乙的VSEPR模型为___________,解释丙的沸点高于乙的原因____________。
(5)可用赤血盐K3[Fe(CN)6]检验元素⑧的+2价阳离子,写出该反应的离子方程式___________,元素⑩的阴离子与元素⑧的+2价离子形成化合物丁,将3molCl2通入含4mol丁的溶液,用一个离子方程式表示该反应过程为____________。
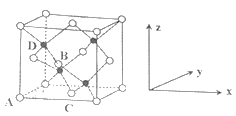
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为⑦和⑨组成的离子化合物戊的晶胞,其中三个离子(白色球)坐标参数A为(0,0,0);B为(,0,);C为(,,0)。则D离子(黑色球)的坐标参数为_____。
②晶胞参数,描述晶胞的大小和形状,已知戊的晶胞参数apm,则晶胞中B和D离子的距离为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷、乙烯、乙醇、乙酸的说法中,不正确的是( )
A.乙烯可以使溴水褪色,发生加成反应
B.甲烷和氯气光照条件下反应,反应类型为取代反应
C.乙醇与金属钠的反应比较激烈
D.生活中可以用食醋除去水壶中的水垢,主要是利用了食醋中醋酸的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法不正确的是( )
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石) ΔH = +1.9 kJ·mol—1可知石墨比金刚石稳定
C.在稀溶液中:H++OH- ![]() H2O ΔH =-57.3 kJ·mol—1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ
H2O ΔH =-57.3 kJ·mol—1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ
D.在热化学方程式中无论是反应物还是生成物必须表明聚集状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
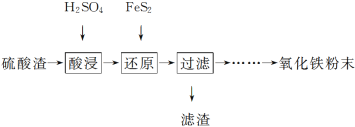
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率。② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO![]() ,该反应的离子方程式为 。
,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量,以控制加入FeS2的量。实验步骤为准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl![]()
Sn2++4Cl-+2HgCl2===SnCl![]() +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++Cr2O![]() +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”或“不变”,下同)
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有的Fe3+。产生Fe3+的原因是 (用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.过滤,洗涤;
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是一种行之有效、简单易行的科学方法。某同学用如下表所示的形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。
甲 | 乙、丙、丁 | |
① | 常见干燥剂 | 浓硫酸、石灰石、碱石灰 |
② | 常见合金 | 不锈钢、青铜、生铁 |
③ | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
④ | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
⑤ | 弱电解质 | 醋酸、一水合氨、水 |
其中正确的组合是( )
A.①② B.③④⑤
C.②③⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+=Fe3++Ce3+
Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述正确的是
A.已知H2燃烧热△H为-285.8kJ/mol,则:2H2(g)+O2(g) ==2H2O(g) △H=-571.6kJ/mol
B.已知稀盐酸与NaOH稀溶液反应的中和热△H为-57.3kJ/mol,则:H2SO4(aq)+2NaOH(aq) ==Na2SO4(aq)+2H2O(l) △H=-57.3kJ/mol
C.电解稀硫酸可能发生反应:Cu+H2SO4![]() CuSO4+H2↑
CuSO4+H2↑
D.以石墨为电极电解MgCl2溶液的总离子方程式:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com