
����Ŀ����֪A��B��C��D��E����Ԫ�ص�ԭ���������ε�����A��B��C��Dλ�ڶ����ڣ�A��ԭ�Ӱ뾶��С��Ԫ�أ�B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����E�С����������֮�ƣ�E4+���ԭ�ӵĺ�������Ų���ͬ��A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬A��B����Ԫ����ɵ�ԭ�Ӹ���֮��Ϊ1��1�Ļ�����N�dz������л��ܼ�����ش��������⣨����ʱ��A��B��C��D��E������Ӧ��Ԫ�ط��ű�ʾ����
��1��A2D2���ӵĵ���ʽΪ �� E�Ļ�̬ԭ�ӵ���Χ�����Ų�ʽΪ ��
��2��B��C��D����Ԫ�صĵ�һ��������С�����˳��Ϊ ��
��3������B��C������������ˮ�����Ũ��Һ�ȷ�Ӧ���仯ѧ����ʽΪ
��4������������ȷ����������ţ���a��M�Ǽ��Է��ӣ�N�ǷǼ��Է��� b�� M��BD2�����е�����ԭ�Ӿ�����sp2�ӻ�
c��N�����к���6���Ҽ���1���м�d��BD2������۵㡢�е㶼�ȶ������辧��ĵ�
��5����֪����E��һ��������Q���侧���ṹ��ͼ��ʾ
��Q��s��+2Cl2��g��=ECl4��l��+D2��g����H=+140kJ/mol
��2B��s��+D2��g��=2BD��g����H=��221kJ/mol
д������Q�ͽ�̿��������Ӧ����Һ̬ECI4��BD������Ȼ�ѧ����ʽ�� ��
���𰸡�
��1��![]() ��3d24s2
��3d24s2
��2��C��O��N
��3��C+4HNO3��Ũ�� ![]() CO2��+4NO2��+2H2O
CO2��+4NO2��+2H2O
��4��ad
��5��2C��s��+TiO2��s��+2Cl2��g��=TiCl4��l��+2CO��g����H=��81kJ/mol
���������⣺A��B��C��D��E����Ԫ�ص�ԭ���������ε�����A��B��C��Dλ��ǰ�����ڣ�A��ԭ�Ӱ뾶��С��Ԫ�أ���AΪ��Ԫ�أ�B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��ԭ�Ӻ���������Ų�Ϊ1s22s22p2 �� ��BΪ̼Ԫ�أ�Dԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3������������Ų�Ϊ1s22s22p4 �� ��DΪ��Ԫ�أ�Cԭ����������̼����֮�䣬��CΪ��Ԫ�أ�A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬������MΪHCHO��A��B����Ԫ����ɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����N�dz������л��ܼ�����NΪ����E�С����������֮�ƣ�E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��Eԭ�Ӻ��������Ϊ18+4=22����EΪTi����1��A2D2����ΪH2O2 �� �����ʽΪ ![]() ��EΪTi��ԭ������Ϊ22�����̬ԭ�ӵ���Χ�����Ų�ʽΪ3d24s2 �� ���Դ��ǣ�
��EΪTi��ԭ������Ϊ22�����̬ԭ�ӵ���Χ�����Ų�ʽΪ3d24s2 �� ���Դ��ǣ� ![]() ��3d24s2����2��ͬ����������ҵ�һ����������Nԭ��p���������Ϊ�ȶ�״̬���ʵ�һ������C��O��N�����Դ��ǣ�C��O��N����3��̼��Ũ�����ȷ�Ӧ�������������Ͷ�����̼�Լ�ˮ���仯ѧ����ʽΪC+4HNO3��Ũ��
��3d24s2����2��ͬ����������ҵ�һ����������Nԭ��p���������Ϊ�ȶ�״̬���ʵ�һ������C��O��N�����Դ��ǣ�C��O��N����3��̼��Ũ�����ȷ�Ӧ�������������Ͷ�����̼�Լ�ˮ���仯ѧ����ʽΪC+4HNO3��Ũ�� ![]() CO2��+4NO2��+2H2O�����Դ��ǣ�C+4HNO3��Ũ��
CO2��+4NO2��+2H2O�����Դ��ǣ�C+4HNO3��Ũ�� ![]() CO2��+4NO2��+2H2O����4��a��HCHO��O��ԭ�ӵ縺�Ժܴ��Ǽ��Է��ӣ�NΪ�����ǷǼ��Է��ӣ���a��ȷ�� b��HCHO��Cԭ���γ�3���Ҽ���û�йµ��Ӷԣ�̼ԭ�Ӳ���sp2�ӻ���������̼����Ϊֱ���ͽṹ��̼ԭ�Ӳ���sp�ӻ�����b����c����������H��C֮����s��sp2�γɵĦҼ���C��C֮����sp2�γɵĦҼ����������к���12���Ҽ���1����м�����c����d��CO2���ڷ��Ӿ��壬������������ԭ�Ӿ��壬������̼���۵㡢�е㶼�ȶ������辧��ĵͣ���d��ȷ����ѡ��ad����5��������Tiԭ����ĿΪ1+8��
CO2��+4NO2��+2H2O����4��a��HCHO��O��ԭ�ӵ縺�Ժܴ��Ǽ��Է��ӣ�NΪ�����ǷǼ��Է��ӣ���a��ȷ�� b��HCHO��Cԭ���γ�3���Ҽ���û�йµ��Ӷԣ�̼ԭ�Ӳ���sp2�ӻ���������̼����Ϊֱ���ͽṹ��̼ԭ�Ӳ���sp�ӻ�����b����c����������H��C֮����s��sp2�γɵĦҼ���C��C֮����sp2�γɵĦҼ����������к���12���Ҽ���1����м�����c����d��CO2���ڷ��Ӿ��壬������������ԭ�Ӿ��壬������̼���۵㡢�е㶼�ȶ������辧��ĵͣ���d��ȷ����ѡ��ad����5��������Tiԭ����ĿΪ1+8�� ![]() =2����ԭ����ĿΪ2+4��
=2����ԭ����ĿΪ2+4�� ![]() =4����������Q�Ļ�ѧʽΪTiO2 �� ��TiO2��s��+2Cl2��g��=TiCl4��l��+O2��g����H=+140kJ/mol��2C��s��+O2��g��=2CO��g����H=��221kJ/mol���ݸ�˹���ɣ�����+�ڿɵ�TiO2�ͽ�̿��������Ӧ����Һ̬TiCI4��CO������Ȼ�ѧ����ʽΪ2C��s��+TiO2��s��+2Cl2��g��=TiCl4��l��+2CO��g����H=��81kJ/mol�����Դ��ǣ�2C��s��+TiO2��s��+2Cl2��g��=TiCl4��l��+2CO��g����H=��81kJ/mol��
=4����������Q�Ļ�ѧʽΪTiO2 �� ��TiO2��s��+2Cl2��g��=TiCl4��l��+O2��g����H=+140kJ/mol��2C��s��+O2��g��=2CO��g����H=��221kJ/mol���ݸ�˹���ɣ�����+�ڿɵ�TiO2�ͽ�̿��������Ӧ����Һ̬TiCI4��CO������Ȼ�ѧ����ʽΪ2C��s��+TiO2��s��+2Cl2��g��=TiCl4��l��+2CO��g����H=��81kJ/mol�����Դ��ǣ�2C��s��+TiO2��s��+2Cl2��g��=TiCl4��l��+2CO��g����H=��81kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�����������Ŀ��
��1��д����ʾ����8�����ӣ�10�����ӵ�ԭ�ӵĻ�ѧ���ţ� ��
��2�������������ش����⣺ ![]() H��
H�� ![]() H��
H�� ![]() H��14C��14N��16O��35Cl2��37Cl2 �� ������8���������ֺ��أ�����Ԫ�أ�
H��14C��14N��16O��35Cl2��37Cl2 �� ������8���������ֺ��أ�����Ԫ�أ�
�ڻ�Ϊͬλ�ص��� ��
����������ȵ����� �� ��������ȵ����� ��
��3����ͬ���ʵ�����14CO2��S18O2������֮��Ϊ��������֮��Ϊ��������֮��Ϊ ��
��4��墨���һ�ּ�����γɵĺϽ�7.8g��������ˮ��Ӧ����0.2g��������˺Ͻ�����һ����������ǣ� �� ��卑����ԭ����ȡ85.5��
��5��������ͬ��H2O��D2O�������Ʒ�Ӧ���ų��������ڱ���µ����֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A.������һ�������¶�����ˮ��
B.��ȥ��֬�е�����ˮ�֣��ȿ�������ˮ������Ҳ�����ü�ʯ��
C.���д��ڵ�ijЩ�������ʹ�����Ҵ����ͣ�����Ϊ̼�ᣬ�ƾ�������ζ
D.����������к�����COOH����NH2����ԭ���ţ����������֮������γɸ��ӵĶ��Ļ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ŵ�����һ���������ʪ�Թؽ���ҩ���ͨ�����·����ϳɣ�

��ش���������
��1���л�������B�еĺ���������Ϊ__________��__________������������
��2��������Ӧ�У����̢�����__________��Ӧ�����̢�����__________��Ӧ��
��3�������̢ٷ�������ȡ����Ӧ������һ�ֲ�����HBr��д����A��B������Ӧ�Ļ�ѧ����ʽ__________________��
��4����ŵ��ҵ�һ��ͬ���칹����������������
��������NaHCO3��Ӧ�ų�CO2������ FeCl3��Һ������ɫ��Ӧ��
������������6 �ֲ�ͬ��ѧ�������⣬�ҷ����к�������������
д������������һ��ͬ���칹��Ľṹ��ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ��������ˮ��Ӧǰ��Ӧ����������ΪʲôҪ�������Ĵ�����______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��ǵ������ڲ���Ԫ�صĵ����ܣ۵�λ��eV�����ӷ��أ������ݣ�����˵����ȷ����
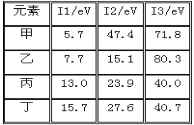
A. �Ľ����Ա�����
B. �ҵĻ��ϼ�Ϊ��1��
C. ��һ��Ϊ�ǽ���Ԫ��
D. ��һ���ǽ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����ظ����ƣ�Na2Cr2O7���ᾧ���ĸҺ������������Fe3+�������ظ���أ�K2Cr2O7�����������̼���������ܽ��������ͼ��
��1����Na2Cr2O7����K2Cr2O7�Ļ�ѧ����ʽΪ �� ͨ����ȴ�ᾧ��������K2Cr2O7��ԭ���� ��
��2����Na2Cr2O7ĸҺ�мӼ�Һ��pH��Ŀ���� ��
��3������A��ҪΪ���ѧʽ��������B��ҪΪ���ѧʽ����
��4������ˮϴ�ӹ���A�����յ�ϴ��Һת�Ƶ�ĸҺ��������У�������߲����ֿ�ʹ�ܺ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com