
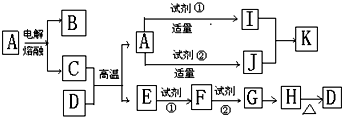
分析 D是红棕色固体,为Fe2O3,H是一种红褐色物质,为Fe(OH)3,A是一种高熔点固体,C与D在高温下反应生成A和E,可判断为铝热反应,所以C为Al,A为Al2O3,E为Fe,电解氧化铝生成B为O2,铁与盐酸反应生成FeCl2,与氢氧化钠反应生成Fe(OH)2,Fe(OH)2与空气的氧气反应生成Fe(OH)3,Fe(OH)3受热分解得Fe2O3,所以试剂①为盐酸,试剂②为NaOH溶液,F为FeCl2,G是Fe(OH)2,Al2O3与盐酸反应生成I是AlCl3,Al2O3与氢氧化钠反应生成J为NaAlO2,AlCl3与NaAlO2反应生成K为Al(OH)3,符合各物质的转化关系,据此解答.
解答 解:D是红棕色固体,为Fe2O3,H是一种红褐色物质,为Fe(OH)3,A是一种高熔点固体,C与D在高温下反应生成A和E,可判断为铝热反应,所以C为Al,A为Al2O3,E为Fe,电解氧化铝生成B为O2,铁与盐酸反应生成FeCl2,与氢氧化钠反应生成Fe(OH)2,Fe(OH)2与空气的氧气反应生成Fe(OH)3,Fe(OH)3受热分解得Fe2O3,所以试剂①为盐酸,试剂②为NaOH溶液,F为FeCl2,G是Fe(OH)2,Al2O3与盐酸反应生成I是AlCl3,Al2O3与氢氧化钠反应生成J为NaAlO2,AlCl3与NaAlO2反应生成K为Al(OH)3,符合各物质的转化关系,
(1)根据上面的分析可知,A为Al2O3,D为Fe2O3,试剂①为HCl,试剂②为NaOH溶液,
故答案为:Al2O3;Fe2O3;HCl;NaOH;
(2)①I溶液和J溶液反应的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓;
①F为FeCl2,F和试剂②反应的离子方程式为Fe2++2OH-=Fe(OH)2↓,
故答案为:Fe2++2OH-=Fe(OH)2↓;
(3)G是Fe(OH)2,G露置在空气中转化为H的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3↓,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3↓.
点评 本题考查无机物推断,“D、H物质的颜色、A的熔点及C、D的反应条件”是推断突破口,需要学生熟练掌握对元素化合物知识,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
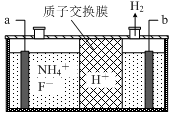 在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 、
、 .
.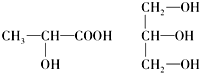
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
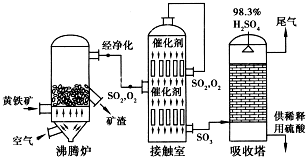
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
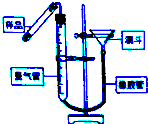 过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.
过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com