
【题目】将3mol/L NaOH溶液滴入到25mL 一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。据图回答:
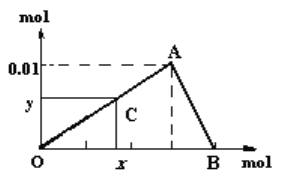
(1)当C点从O点向A点运动时,表示随着OH-的不断加入,沉淀量逐渐________。OA曲线表示的离子反应是:______________________________;由此可得A点的坐标为_______;此时加入氢氧化钠溶液的体积为____________;
(2)AB曲线表示的离子反应为:___________________,由此可得B点的坐标为:_________。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:_____mol/L。
(4)当x=0.035时,铝元素在体系中的存在形式为________,其物质的量为____________。
【答案】 增加 Al3+ + 3OH—=Al(OH)3↓ (0.03,0.01) 10mL Al(OH)3 + OH— =AlO2— + 2H2O (0.04,0) 0.4 Al(OH)3 、AlO2— 0.005mol、 0.005mol
【解析】根据图像,当C点从O点向A点运动时,表示随着OH-的不断加入,沉淀量逐渐增加,A点Al3+刚好完全沉淀,沉淀量达最大值;从A点到B点,随着OH-的不断加入,沉淀量逐渐减少,B点时Al(OH)3刚好完全溶解。根据纵坐标n[Al(OH)3]max=0.01mol和Al守恒,原n(AlCl3)=0.01mol,依据AlCl3物质的量和相关方程式进行计算。
根据图像,当C点从O点向A点运动时,表示随着OH-的不断加入,沉淀量逐渐增加,A点Al3+刚好完全沉淀,沉淀量达最大值;从A点到B点,随着OH-的不断加入,沉淀量逐渐减少,B点时Al(OH)3刚好完全溶解。根据纵坐标n[Al(OH)3]max=0.01mol和Al守恒,原n(AlCl3)=0.01mol。
(1)当C点从O点向A点运动时,表示随着OH-的不断加入,沉淀量逐渐增加,OA曲线表示的离子反应是:Al3++3OH-=Al(OH)3↓,则A点消耗的n(OH-)=3![]() 0.01mol=0.03mol,由此可得A点的坐标为(0.03,0.01)。此时加入NaOH溶液的体积为
0.01mol=0.03mol,由此可得A点的坐标为(0.03,0.01)。此时加入NaOH溶液的体积为![]() =0.01L=10mL。
=0.01L=10mL。
(2)AB曲线表示Al(OH)3溶于NaOH,表示的离子反应为Al(OH)3+OH-=AlO2-+2H2O。溶解0.01molAl(OH)3消耗n(OH-)=0.01mol,则B点的坐标为(0.04,0)。
(3)原n(AlCl3)=0.01mol,c(AlCl3)=![]() =0.4mol/L,AlCl3溶液中Al3+离子的浓度为0.4mol/L。
=0.4mol/L,AlCl3溶液中Al3+离子的浓度为0.4mol/L。
(4)当x=0.035时,加入OH-物质的量大于0.03mol(A点)小于0.04mol(B点),说明AlCl3完全沉淀后并溶解了部分Al(OH)3,铝元素在体系中的存在形式为Al(OH)3和AlO2-。加入0.03molOH-时AlCl3完全沉淀生成0.01molAl(OH)3沉淀,x=0.035mol时,溶解Al(OH)3消耗的n(OH-)为0.035mol-0.03mol=0.005mol,根据离子反应Al(OH)3+OH-=AlO2-+2H2O,0.005molOH-溶解0.005molAl(OH)3同时生成0.005molAlO2-,留下的Al(OH)3为0.01mol-0.005mol=0.005mol;当x=0.035时,铝元素在体系中的存在形式为Al(OH)3和AlO2-,Al(OH)3和AlO2-物质的量都为0.005mol。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
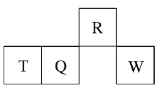
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 单质T与NaOH溶液不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯气及氯水的叙述中,下列正确的是( )
A.纯净的氯气是一种黄绿色、有毒的气体,具有漂白性
B.可用干燥的石蕊试纸验证氯水是否变质
C.氯气能与铁反应,液氯不宜贮存在钢瓶中
D.氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是一种新型绿色氧化剂,制备高铁酸钾的工艺流程如下:
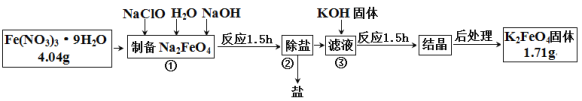
回答下列问题:
(1)步骤①中NaClO作______(填“氧化剂”“还原剂”或“催化剂”)。
(2)步骤②脱除的盐除NaNO3 外,还有 ____________(填化学式)。
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4 _____(填“>”或“<”)K2FeO4。
(4)本次实验中K2FeO4的产率为__________________。
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸入一根带火星的木条,木条复燃;再向溶液中加入KSCN溶液,溶液变为血红色。如果标况下产生气体2.24L,则参加反应的FeO42- 数目_____________;K2FeO4作为净水剂的优点除铁无毒,能消毒杀菌外还有__________________________________。
(6)某同学设计以下两个实验探究高铁酸钾的稳定性。
(实验1)将适量K2FeO4固体分别溶解于pH为4.74、7.00、11.50的水溶液中,配得FeO42-浓度为1.0mmolL-1(1mmolL-1=10-3molL-1)的试样,静置,结果见图1。
(实验2)将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42-浓度为1.0mmolL-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,结果见图2。
(实验结论)根据图一,可以得出的结论是:________________________________________
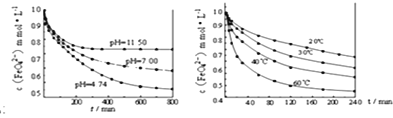
图1 图2
(7)常温下,某水溶液含有Fe3+,Cu2+,调节溶液pH=10时,两种氢氧化物沉淀共存,已知该温度下, Ksp(Fe(OH)3)= a, Ksp(Cu(OH)2)= b,则溶液中C(Fe3+)/C(Cu2+)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与装置均正确的是( )

A. 用甲装置从青蒿中提取对治疗疟疾有特效的青蒿素
B. 用乙装置配制酸碱中和滴定的标准液(0.1000mol/L HCl)
C. 用丙装置从海带灰中提取碘单质
D. 用丁装置将含等物质的量的K2SO4和Al2(SO4)3的混合溶液蒸干得到明矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收利用并获得能量,原理如图所示。下列说法正确的是( )
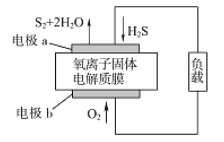
A. 电极b为电池负极
B. 电极a上的电极反应:2H2S+2O2--4e-=S2+2H2O
C. 电极b上的电极反应:O2+4e-+4H+=2H2O
D. 电路中每流过4mol电子,正极消耗44.8LH2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A. pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③
B. 0.2mol·L-1HCl与0.1 mol·L-1NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(OH-)>c(H+)
C. 0.2 mol·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
D. pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列各种共价键的键能:C—H:a kJ· mol-1、O—H:b kJ· mol-1、O=O:c kJ·mol-1、C=O:d kJ·mol-1。写出甲烷气体完全燃烧生成CO2气体和气体水的热化学方程式:_________________________________
(2)火箭中的主要燃料是“肼(也称为联氨)”的液体物质。此化合物的相对分子质量为32。其中,含N的质量分数为87.5%,其余为H元素。则:
①肼的化学式为__________________,其结构式为_____________________________
②此燃料的氧化剂是N2O4气体,若燃烧0.2 mol肼液体放出的热量为 400 kJ,燃烧的产物对大气都无污染(生成的水为液态),则肼与N2O4气体反应的热化学方程式为:__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3
C. 室温下,SiO2(s)+3C(s)=SiC(s)+2CO(g)不能自发进行,则该反应的△H<0
D. 反应A(g) ![]() B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=(Ea-Eb)kJ/mol
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=(Ea-Eb)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com