
【题目】(I)我国化工专家侯德榜的“侯氏制碱法” 又叫“联合制碱法”以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱Na2CO3,有关反应的化学方程式:
(1)____;
(2)____。
(II).取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:①滴加适量H2O2,紫红色褪去,并有气泡产生;②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色; ③最后通入足量的SO2气体。请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为__;
(2)实验③中的现象为__;
(3)实验①、②中反应的离子方程式分别是__、___。
(III)铝与NaOH溶液反应同温同压下,在体积和浓度均为100mL2mol·L1的盐酸和NaOH溶液中各加入等质量的Al,产生气体的体积之比为5∶6,则所加Al的质量为__g。
【答案】NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 2NaHCO3![]() Na2CO3+CO2↑+H2O PbO2>KMnO4>H2O2 溶液紫红色褪去,有白色沉淀生成 2MnO4+5H2O2+6H+=2Mn2++5O2↑+8H2O 5PbO2+2Mn2++4H+=5Pb2++2MnO4+2H2O 2.16
Na2CO3+CO2↑+H2O PbO2>KMnO4>H2O2 溶液紫红色褪去,有白色沉淀生成 2MnO4+5H2O2+6H+=2Mn2++5O2↑+8H2O 5PbO2+2Mn2++4H+=5Pb2++2MnO4+2H2O 2.16
【解析】
(I)“联合制碱法”是向饱和食盐水中通入氨气和二氧化碳,生成碳酸氢钠沉淀,加热碳酸氢钠,分解生成碳酸钠、二氧化碳、水;
(II)(1)根据氧化剂的氧化性大于氧化产物判断;
(2)二氧化硫具有还原性,二氧化硫能还原高锰酸钾;
(3)实验①是高锰酸钾把过氧化氢氧化为氧气;实验②是PbO2把Mn2+氧化为MnO4;
(III)铝与盐酸反应的化学方程式是2Al+6HCl═2AlCl3+3H2↑,铝与氢氧化钠反应的化学方程式是2Al+2NaOH+2H2O═2NaAlO2+3H2↑;根据题意,盐酸、氢氧化钠物质的量相等,若盐酸、氢氧化钠都完全反应,则盐酸、氢氧化钠生成气体体积比为V(盐酸)∶V(氢氧化钠)=1∶3,若两份铝都完全反应,则生成氢气体积相等,实际生成氢气体积比V(盐酸)∶V(氢氧化钠)=5∶6,说明氢氧化钠有剩余、盐酸中铝有剩余。
(I)“联合制碱法”是向饱和食盐水中通入氨气和二氧化碳,生成碳酸氢钠沉淀,反应方程式是NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,加热碳酸氢钠,碳酸氢钠分解生成碳酸钠、二氧化碳、水,反应方程式是2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(II)(1)取一定量的酸性KMnO4溶液,滴加适量H2O2,紫红色褪去,并有气泡产生,有氧气生成,KMnO4是氧化剂、H2O2是还原剂,说明氧化性KMnO4> H2O2;再加入适量的PbO2固体,固体溶解,溶液又变为紫红色,说明又生成KMnO4,PbO2是氧化剂、KMnO4是氧化产物,氧化性:PbO2 >KMnO4 ,故氧化性:PbO2>KMnO4>H2O2;
(2)向高锰酸钾溶液中通入足量的SO2气体,二氧化硫被氧化为硫酸根离子,Pb2+与SO42-反应生成PbSO4沉淀,所以现象是溶液紫红色褪去,有白色沉淀生成;
(3)实验①是高锰酸钾把过氧化氢氧化为氧气,反应的离子方程式是2MnO4+5H2O2+6H+=2Mn2++5O2↑+8H2O;
反应②是PbO2把Mn2+氧化为MnO4,反应的离子方程式是5PbO2+2Mn2++4H+=5Pb2++2MnO4+2H2O。
(III)盐酸和氢氧化钠溶液中溶质的物质的量均为0.1L×2mol/L=0.2mol,
根据以上分析,盐酸完全反应,盐酸中的铝有剩余, 设铝与酸反应时生成的氢气的物质的量为xmol,
则 ![]()
![]()
X=0.1mol,
测得生成的气体体积比为V(盐酸)∶V(氢氧化钠)=5∶6,则氢氧化钠与铝反应生成氢气的物质的量是0.12mol,设氢氧化钠溶液中参加反应的铝为ymol
则
![]()
![]()
,解得y=0.08mol,
则铝的质量为0.08mol×27g/mol=2.16g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1 |
|
实验2 |
|
下列分析正确的是( )
A. 实验1中,白色沉淀a是Al2(CO3)3
B. 实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C. 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种物质存在如图转化关系,下列判断正确的是
![]()
A.若W是一种常见的金属单质,则X可能为![]()
B.若W为强碱,Y为白色难溶于水的固体,则工业上可以电解X的水溶液来制取其中所含的金属
C.若W固体俗称干冰,则Y晶体中的阴、阳离子个数比为1∶1
D.若W是![]() ,则Y一定是酸性氧化物
,则Y一定是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将70g过氧化钠和氧化钠混合物与98g水充分反应,所得溶液恰好能被含硫酸98g的酸溶液中和,求:
(1)原混合物中过氧化钠和氧化钠的质量分别是多少?___
(2)所得氢氧化钠溶液的质量分数是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计出燃料电池使汽油(设其成分为C5H12)氧化直接产生电流是21世纪最富有挑战性的课题之一。最近有人设计了一种固体燃料电池,固体氧化铝——氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如右图所示,其中多孔电极a、b均不参与电极反应。下列判断不正确的是
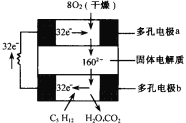
A.有O2放电的a极为电池的负极
B.b极对应的电极反应式为:C5H12+16O2--32e-=5CO2+6H2O
C.该电池的总反应方程式为:C5H12+8O2=5CO2+6H2O
D.汽油燃料电池最大的技术障碍是氧化反应不完全,产生炭粒堵塞电极的气体通道,从而使输电效能减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有200mL3mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉质量为( )
A.10.8gB.7.2gC.5.4gD.3.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四苯基乙烯(TFE)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TFE的两条合成路线(部分试剂及反应条件省略):
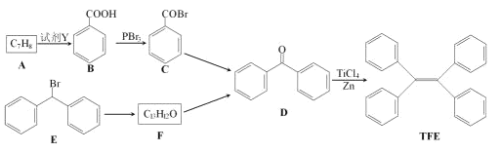
已知反应:![]() 。
。
回答下列问题:
(1)TFE的分子式为______________。
(2)A的名称为______________。
(3)A→B,E→F的反应类型分别为______________、______________。
(4)F→D的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
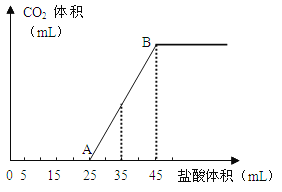
请回答下列问题:
(1)写出OA段所发生反应的离子方程式
________________________________________________
__________________________________________ 。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com