
设NA为阿伏加德罗常数的值,标准状况下某O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是()
A. 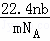 L B.
L B.  C.
C. 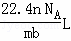 D.
D. 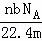 L
L
考点: 气体摩尔体积.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: 先求出ng该混合气体含有的分子数,再求出混合气体物质的量,最后根据标准状况下的气体摩尔体积求出体积.
解答: 解:根据其组分及其含量相同,所以其质量与分子数成正比,设ng该混合气体含有的分子数为x个,
质量与分子数的比列式为:mg:b=ng:x,
x=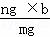 =
= 个;
个;
ng该混合气体含有的物质的量为:n=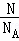 =
= =
= mol,
mol,
其体积为:V=n×Vm = mol×Vm =
mol×Vm = mol×22.4l/mol=
mol×22.4l/mol= L
L
故选:A.
点评: 本题考查了物质的量、质量、气体摩尔体积之间的关系,题目难度不大,灵活运用公式是解题的关键,这种类型的题在2015届高考选择题中经常出现.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
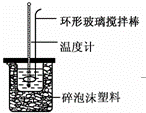
实验室用50mL 0.50mol•L﹣1盐酸、50mL 0.55mol•L﹣1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 起始温度t1/℃ 终止温度t2/℃
盐酸 NaOH溶液
1 20.2 20.3 23.7
2 20.3 20.5 23 .8
.8
3 21.5 21.6 24.9
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 .
(2)在操作正确的前提下,提高中和热测定准确性的关键是: .
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H= .如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、“不变”).
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温 较高
较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学科学的叙述中,正确的是()
A. 化学学科与其他学科分支的联系不紧密
B. 化学知识只是在工业生产中起到重要作用
C. 化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中
D. 化学科学是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的重要自然科学
查看答案和解析>>
科目:高中化学 来源: 题型:
下面对氯气的叙述正确的是()
A. 因为氯气有毒,所以氯气可用于自来水的杀菌消毒
B. 氯气可使湿润的红布条退色,但氯气本身不具有漂白性
C. 在通常情况下,氯气可以和任何金属直接化合
D. 闻其气味时要小心将集气瓶放在鼻孔下直接闻
查看答案和解析>>
科目:高中化学 来源: 题型:
将钠、镁、铝各0.3mol分别加入100mL 1mol/L 的盐酸中,在同温同压下产生的气体体积比是()
A. 1:2:3 B. 6:3:2 C. 3:1:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
日常生活中很多问题涉及到化学知识.下列叙述正确的是()
A. 用食醋清洗热水瓶中的水垢;用米汤检验碘盐中含有碘酸钾
B. 用小苏打可中和胃酸,热纯碱溶液可除油污.小苏打和纯碱可以用石灰水鉴别
C. “84消毒液”和洁厕剂能同时使用,除污垢效果好
D. 用丁达尔效应区别鸡蛋白溶液和食盐水;用明矾可以净水
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
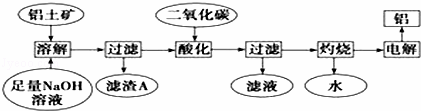
已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的Na2SiO3与Na2与 反应,能生成硅铝酸盐沉淀,化学反应方程式为:
反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2Na2═2Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中主要发生反应的离子方程式: ; .
(2)滤渣A的主要成分为 ;滤渣A的用途是(只写一种) .
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂.工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O,
干法制备的主要反应方程为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
则下列有关说法正确的是()
A. 高铁酸钾中铁显+6价
B. 湿法中FeO42﹣是还原产物
C. 干法中每生成1mol Na2FeO4 转移4mol电子
D. K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com